【背景】 ステロイド/甲状腺ホルモン核内受容体が、遺伝子の転写を活性化する機序は活発に研究されてきた。とりわけビタミンD受容体(VDR)、甲状腺ホルモン受容体(TR)レチノイン酸受容体(RAR)については、レチノイン酸X受容体(RXR)をパートナーとしたヘテロダイマーを構成することにより、リガンド依存性に特異的効果をもたらすということが、共通の分子メカニズムとして確立しつつある。しかし、これと異なり、転写抑制に関与する場合の機序は依然充分理解されていない。
Demayらは、ビタミンDによって負の転写調節を受けるヒト副甲状腺ホルモン(PTH)遺伝子上流に、この抑制に関与するエレメント(negative vitamin D response element:nVDRE)を初めて報告した。Umesonoらはによれば、ビタミンDによる正の遺伝子制御に関与するエレメント(VDRE)は、3塩基のスペーサーを挟んで、コンセンサスAGGTCAの6塩基モチーフが2回ダイレクトリピートする構造をとるが、マウス、オステオポンチンのエレメントなどは、AGGTTCAという7塩基モチーフが2塩基のスペーサーを挟んでダイレクトリピートすると解釈することもできる。Demayらの、ヒトPTH遺伝子の負の転写調節エレメント(nVDREhPTH)はAGGTTCAという、全く同じ7塩基モチーフを単一コピーのみ有する。彼らはまたこのエレメントを介した転写調節にVDRは関与するがRXRは関与しないこと、他の未知の蛋白がVDRのパートナーとなっていることを示した。
PTH遺伝子と共通の祖先遺伝子に由来するとされるヒトPTH関連ペプチド(human PTH-related peptide:PTHrP)は、いくつかの腫瘍に伴い過剰産生され高カルシウム血症をきたすことがある。Inoueらは、成人T細胞リンパ腫/白血病ウイルスの感染した細胞株であるMT2細胞において産生されるPTHrPが、1,25水酸化ビタミンD3(1,25-D3)によって転写抑制を受けることを報告した。さらに、成人T細胞リンパ腫/白血病などに伴う液性高カルシウム血症に対して、ビタミンDを治療に使える可能性を議論している。
今回、我々はPTHrPの遺伝子の上流域にnVDREhPTHと非常によく似た配列を見出し、MT2細胞における、ビタミンDによるPTHrP遺伝子の負の転写調節の分子機構について検討した。
【結果】 我々はヒトPTHrP遺伝子の第1エクソンの540塩基上流領域に、ヒトPTH(hPTH)遺伝子に存在するnVDRE(nVDREhPTH)と類似したDNA配列(nVDREhPTHrP)を見い出した。nVDREhPTHrPの13塩基中11塩基がnVDREhPTHのアンチストランドと同一である。これら両者ともAGG(or A)TTCAというDNAモチーフを持っている。このモチーフは、VDRなどの核内ホルモン受容体の結合のためのコア・モチーフ(AGG(or A)TCA)に類似する。マウス・オステオポンチン遺伝子の促進的ビタミンD反応性エレメント(VDREmop)はこれと同じモチーフのダイレクトリピートから成る。nVDREhPTHとnVDREhPTHrPでは、7塩基モチーフに隣接するCTATという4塩基もが共通している。これらのことは両者が1,25-D3による負の遺伝子調節に関与する可能性を示唆する(下図)。
 図.負のVDRE
図.負のVDRE 我々はまず、nVDREhPTHrPおよびVDREmopオリゴヌクレオチドを化学合成しこれらのオリゴヌクレオチドと、MT2細胞から抽出された核蛋白との相互作用をゲルシフトアッセイ(EMSA)にて評価した。どちらのオリゴヌクレオチドもMT2核蛋白とDNA-蛋白複合体を形成した。nVDREhPTHrP-MT2核蛋白複合体は、放射性ラベルを入れないnVDREhPTHrPによって競合されたが、VDREmopによっては競合されなかった。逆にVDREmopとMT2核蛋白の結合はVDREmopによって競合されたがnVDREhPTHrPによっては競合されなかった。この結果は、これら2つのDNA-蛋白複合体の間で、核蛋白の構成が少なくとも一部は異なっていることを示唆する。
VDRとRXR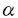 はMT2細胞以外の種々の細胞において、VDREmopを介するビタミンDによる促進的転写調節に必要であることが示されている。MT2細胞においても、これら両者の抗体はEMSAにおいてVDREmop-MT2蛋白結合を減弱した。ところが、nVDREhPTHrP-MT2核蛋白複合体の形成は、抗VDR抗体によって減弱したが、抗RXR
はMT2細胞以外の種々の細胞において、VDREmopを介するビタミンDによる促進的転写調節に必要であることが示されている。MT2細胞においても、これら両者の抗体はEMSAにおいてVDREmop-MT2蛋白結合を減弱した。ところが、nVDREhPTHrP-MT2核蛋白複合体の形成は、抗VDR抗体によって減弱したが、抗RXR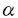 抗体によって影響を受けなかった。この結果からnVDREhPTHrP-MT2核蛋白複合体はVDRを含むがRXR
抗体によって影響を受けなかった。この結果からnVDREhPTHrP-MT2核蛋白複合体はVDRを含むがRXR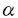 は含まないことが示唆された。
は含まないことが示唆された。
次にこのnVDREhPTHrPがMT2細胞におけるビタミンDによる転写抑制に必要であるのか、CATアッセイを行った。nVDREhPTHrPとTk(thymidine kinase)プロモーターを繋ぎその下流にCATを接続したプラスミド(nVDREhPTHrP-Tk-CAT)と、コントロールとしてnVDREhPTHrPを含まないプラスミド(Tk-CAT)をMT2細胞に導入した。10-8Mの1,25-D3処理は、nVDREhPTHrP-Tk-CATの活性を選択的に減弱しTk-CATの活性は弱めなかった。1,25-D3以外の活性の弱いビタミンD代謝物ではこの作用は認められなかった(下図)。
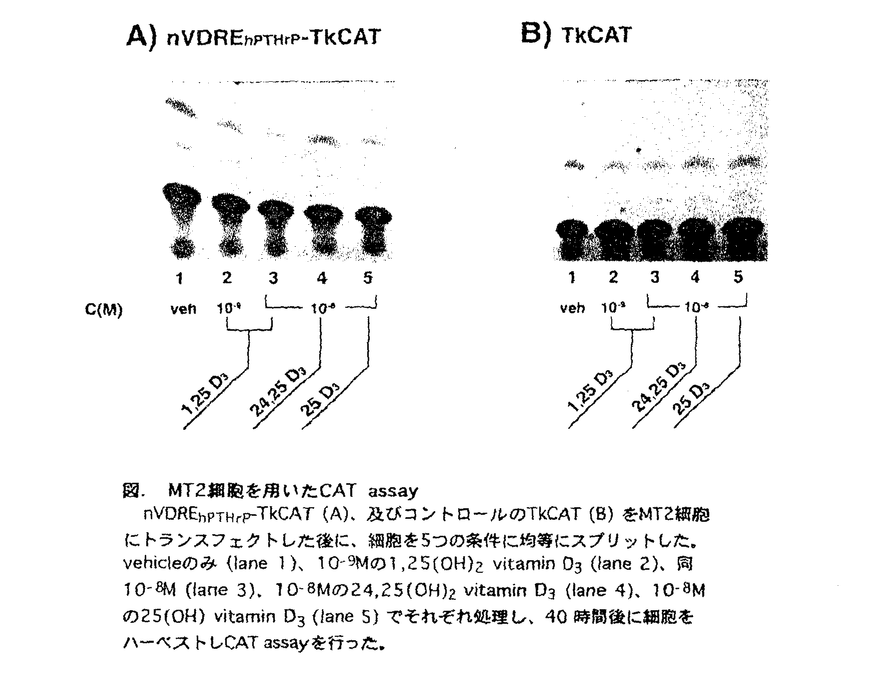 図.MT2細胞を用いたCAT assaynVDREhPTHrP-TkCAT(A)、及びコントロールのTkCAT(B)をMT2細胞にトランスフェクトした後に、細胞を5つの条件に均等にスプリットした。vehicleのみ(lane 1)、10-9Mの1,25(OH)2vitamin D3(lane 2)、同10-8M(lane 3)、10-8Mの24,25(OH)2vitamin D3(lane 4)、10-8Mの25(OH)vitamin D3(lane 5)でそれぞれ処理し、40時間後に細胞をハーベストしCAT assayを行った。
図.MT2細胞を用いたCAT assaynVDREhPTHrP-TkCAT(A)、及びコントロールのTkCAT(B)をMT2細胞にトランスフェクトした後に、細胞を5つの条件に均等にスプリットした。vehicleのみ(lane 1)、10-9Mの1,25(OH)2vitamin D3(lane 2)、同10-8M(lane 3)、10-8Mの24,25(OH)2vitamin D3(lane 4)、10-8Mの25(OH)vitamin D3(lane 5)でそれぞれ処理し、40時間後に細胞をハーベストしCAT assayを行った。 次に、リガンドであるビタミンDが、nVDREhPTHrP-MT2核蛋白結合に与える影響をEMSA及びサウスウエスタンプロッティングにて検討した。1,25-D3はnVDREhPTHrP-蛋白結合を約50%減弱した。24,25-D3はこのような作用を示さなかった。
次に我々はnVDREhPTHrP-MT2核蛋白複合体において、VDRのパートナーとなっている可能性がある核蛋白に興味を持った。nVDREhPTHrPは、その中のコア・モチーフに隣接して、オクタマー(ATTTGCAT)様の配列(ATTTGGTT)を有している。我々は、以前これに類似の配列に、DNA末端結合蛋白として知られるKu抗原が他の蛋白と伴に結合し、細胞外カルシウムによるPTH遺伝子の転写抑制に関与する可能性を示した。このため我々はKu抗原がnVDREhPTHrPを介したビタミンDによる遺伝子抑制にも関与する可能性を考えた。抗Ku抗原抗体をEMSAに加えるとnVDREhPTHrP-MT2核蛋白複合体の形成を抑制したが、VDREmop-MT2核蛋白複合体の形成は抑制しなかった。
nVDREhPTHrPを介するビタミンDによる遺伝子抑制に、Ku抗原が果たすin vivoの役割を知るために、Ku抗原のp70およびp86の両サブユニットをアンチセンスの向きに組み込んだ発現ベクターを、nVDREhPTHrPあるいはVDREmopを含むレポーターブラスミドと伴にMT2細胞に一過性に導入した。1,25-D3はベクターのみを導入した対照群のnVDREhPTHrP-Tk-CAT活性を抑制したが、Ku抗原の両サブユニットのアンチセンス発現ベクターをMT2細胞に導入したところ、元来見られた、1,25-D3によるnVDREhPTHrP-Tk-CATの発現抑制現象が見られなくなった。一方で1,25-D3はVDREmop-TkCATによるCAT活性に対し促進効果を示し、これはアンチセンス発現ベクターの影響を受けなかった。この結果はKu抗原が、nVDREhPTHrPを介するビタミンDによる転写抑制にも関与することを示すと考えられる。
【考察】 最近、ビタミンDによる負の遺伝子制御に関わるDNA配列の報告がいくつか見られる。FalzonはラットPTHrP遺伝子の上流に2つのビタミンDによる遺伝子抑制に重要なエレメントを報告した。これらのうちの一つは第一エクソンの-726塩基上流に存在し、AGGTTCTという7塩基のモチーフを有する。この配列はnVDREhPTHrPと類似しており、しかも同じ向きに配列している。さらにこれらに隣接する5塩基GTGCTもヒト及びラットPTHrP遺伝子のnVDREの間で共通である。我々のnVDREhPTHrPは、ラットPTHrP及びヒトPTH遺伝子のnVDREと同様にコア・モチーフのシングルコピー型のnVDREに分類される。これらには共通に、VDRがRXR以外の核蛋白と伴に結合する可能性がある。
Ku抗原は普遍的に存在する核蛋白でいくつかのサブユニットからなり、DNA依存性キナーゼの構成要素であることが知られている。DNA末端に非特異的に結合するが、また一方で、いくつかの特異的な内部配列に結合することも知られている。また、最近Ku抗原はMMTV(mouse mammary tumor virus)LTRの内部配列に結合してグルココルチコイド受容体を介したMMTVの発現促進を抑制することも知られている。
我々は、VDRがRXR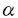 以外の核蛋白と伴にシングルコピー型のnVDREであるnVDREhPTHrPに結合し、PTHrP遺伝子のビタミンDによる転写抑制に関与するという結果を示した。また分子的機構は不明であるが、リガンドであるビタミンDが、DNA-核蛋白結合活性を減弱するという結果を得た。さらに我々はVDRのパートナーがKu抗原である可能性を示した。しかもこれらを、MT2細胞という、臨床的に意味のある細胞系で検討し得たと考える。
以外の核蛋白と伴にシングルコピー型のnVDREであるnVDREhPTHrPに結合し、PTHrP遺伝子のビタミンDによる転写抑制に関与するという結果を示した。また分子的機構は不明であるが、リガンドであるビタミンDが、DNA-核蛋白結合活性を減弱するという結果を得た。さらに我々はVDRのパートナーがKu抗原である可能性を示した。しかもこれらを、MT2細胞という、臨床的に意味のある細胞系で検討し得たと考える。