| 内容要旨 | | I要旨 LTB4(leukotriene B4)はアラキドン酸の5-リポキシゲナーゼ代謝産物で、強力な白血球遊走能及び活性化能を持つことより、炎症や免疫反応の重要なメディエーターであると考えられている。その受容体は未だに精製やcDNAクローニングに至っておらず、共役するGタンパク質や細胞内シグナルなどは十分に明らかになっていない。LTB4受容体(LTB4R)は、多形核白血球に多く分布し、細胞内Ca2+濃度上昇とイノシトールリン脂質代謝亢進を起こす。血球細胞ではこれらのシグナルが百日咳毒素感受性であると報告されており、LTB4RはG1と共役する細胞膜7回貫通型受容体であると想定されている。しかし、血球以外ではシグナルが百日咳毒素非感受性であるという報告もある。本研究では、ブタ白血球のLTB4R(解離定数Kd=23.8nM)を可溶化し、RCA120レクチンカラムに通してGタンパク質と分離した後、内在性及び外来性の各種Gタンパク質と再構成させて、その共役を検討した。RCA120カラムの素通り画分(Gタンパク質画分)を吸着画分(受容体画分,Kd=500nM)に添加した後に界面活性剤を除くと、内在性のGタンパク質と受容体が再構成され、〔3H〕LTB4結合能は約5倍に増加し、親和性も上昇した(Kd=50nM)。また、外来性のGタンパク質、すなわち、ウシ脳から精製された3量体Gi2やバキュロウイルス-Sf9系で発現したGi1,Gi2,Gi3,GOの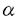 サブユニット、さらにSf9に サブユニット、さらにSf9に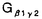 と共発現したGi1,Gi2,Gi3,GOなどとも再構成され、LTB4結合能は増加した。 と共発現したGi1,Gi2,Gi3,GOなどとも再構成され、LTB4結合能は増加した。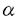 サブユニット(Gi1,Gi2,Gi3,GO)及び サブユニット(Gi1,Gi2,Gi3,GO)及び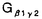 と共発現したGi1,Gi2,Gi3,GOとの再構成はいずれも同程度に成立し、実際に白血球に存在して百日咳毒素感受性であるGi2やGi3とLTB4Rが共役することを確認できた。また、外来性 と共発現したGi1,Gi2,Gi3,GOとの再構成はいずれも同程度に成立し、実際に白血球に存在して百日咳毒素感受性であるGi2やGi3とLTB4Rが共役することを確認できた。また、外来性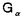 との再構成には、RCA120素通り画分をGTP との再構成には、RCA120素通り画分をGTP S前処理したものが必要で、そこに存在するリン脂質や S前処理したものが必要で、そこに存在するリン脂質や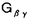 の関与が考えられた。今回構築した再構成系は、精製過程でGタンパク質が分離して低親和性となった受容体の親和性を回復させることが可能で、今後の受容体の精製にも有用であると考えられた。 の関与が考えられた。今回構築した再構成系は、精製過程でGタンパク質が分離して低親和性となった受容体の親和性を回復させることが可能で、今後の受容体の精製にも有用であると考えられた。 II実験方法(1)レセプター標品の調製と可溶化 ブタ血液からデキストラン沈降法を用いて末梢白血球を調製した。超音波処理で破砕した後、分画遠心にて、130,000×g,90分の膜画分を調製した。可溶化は、膜を0.15M NaCl,0.2%CHAPSで洗浄後、タンパク質濃度1mg/mlとなるように、緩衝液50mM Tris-HCl(pH7.4),10mM MgCl2,2mM EDTA,2mM DTT,0.5mM PMSF,1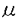 M GDPに再懸濁して0.5%CHAPSで30分間処理し、130,000×gの超遠心の上清を可溶化画分とした。 M GDPに再懸濁して0.5%CHAPSで30分間処理し、130,000×gの超遠心の上清を可溶化画分とした。 (2)結合実験 受容体と[3H]LTB4(0.25nM)の結合は10mM MgCl2,10mM NaClの存在下に50mM Tris-HCl(PH7.4)200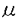 lで25℃,1時間行った。非特異的結合の測定は1 lで25℃,1時間行った。非特異的結合の測定は1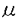 M LTB4の存在下で行った。膜画分の場合は、氷冷した緩衝液を加えて反応を停止させた後、ガラスフィルターを用いて吸引濾過し、緩衝液で洗浄した後に乾燥させ、放射活性を測定した。可溶化画分の場合は、NAP-5(Sephadex G-25)ゲル濾過カラムを用いた方法で行った。具体的には上記反応液200 M LTB4の存在下で行った。膜画分の場合は、氷冷した緩衝液を加えて反応を停止させた後、ガラスフィルターを用いて吸引濾過し、緩衝液で洗浄した後に乾燥させ、放射活性を測定した。可溶化画分の場合は、NAP-5(Sephadex G-25)ゲル濾過カラムを用いた方法で行った。具体的には上記反応液200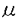 lをNAP-5カラムにかけ、500〜1300 lをNAP-5カラムにかけ、500〜1300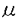 lに溶出される画分の放射活性を測定した。 lに溶出される画分の放射活性を測定した。 (3)レクチンカラムによる内在性Gタンパク質の分離と再構成 FPLC Systemを用い、緩衝液10mMリン酸ナトリウム(pH7.4),150mM NaClで平衡化したRCA120カラムに可溶化画分を通して、素通りするGタンパク質画分とlactoseで溶出されてくる受容体画分とに分離した。受容体画分450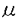 lに濃縮したGタンパク質画分を50 lに濃縮したGタンパク質画分を50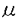 lの割合で添加して総量を500 lの割合で添加して総量を500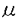 lとし、NAP-5に直ちにかけて、過剰のCHAPSを除去し、再構成標品を調製した。 lとし、NAP-5に直ちにかけて、過剰のCHAPSを除去し、再構成標品を調製した。 (4)外来性Gタンパク質の調製 ウシ脳の膜標品を1%コール酸ナトリウムで可溶化し、3量体Gタンパク質の状態で精製されたものを用いて受容体画分との再構成を検討した。 ウシの遺伝子から作成された組み換えバキュロウイルスをSf9に感染させると、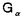 は細胞質に、 は細胞質に、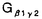 は細胞膜に、 は細胞膜に、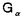 と と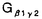 を共発現させた場合は細胞膜に発現した。それぞれ、感染後、浮遊培養を60時間施行し、回収した細胞を超音波処理で破砕した。細胞質と1%コール酸ナトリウムによる可溶化膜を調製して、再構成の検討に用いた。 を共発現させた場合は細胞膜に発現した。それぞれ、感染後、浮遊培養を60時間施行し、回収した細胞を超音波処理で破砕した。細胞質と1%コール酸ナトリウムによる可溶化膜を調製して、再構成の検討に用いた。 (5)外来性Gタンパク質との再構成 GTP S前処理(0.2M硫安,10mM MgCl2,1 S前処理(0.2M硫安,10mM MgCl2,1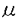 M GTP M GTP Sで30℃,2時間処理)したRCA120素通り画分を調製した。受容体画分を440 Sで30℃,2時間処理)したRCA120素通り画分を調製した。受容体画分を440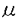 l、GTP l、GTP S前処理-素通り画分を50 S前処理-素通り画分を50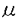 lに外来性Gタンパク質画分を10 lに外来性Gタンパク質画分を10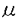 lの割合で添加して総量を500 lの割合で添加して総量を500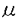 lとし、NAP-5に直ちにかけてCHAPSや過剰のGTP lとし、NAP-5に直ちにかけてCHAPSや過剰のGTP Sを除去して再構成の検討を行った。Sf9の3量体Gタンパク質可溶化画分の場合は、受容体画分450 Sを除去して再構成の検討を行った。Sf9の3量体Gタンパク質可溶化画分の場合は、受容体画分450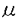 lにGタンパク質画分を50 lにGタンパク質画分を50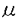 lの割合で添加した後にNAP-5にかけて、CHAPSやコール酸ナトリウムを除去し、GTP lの割合で添加した後にNAP-5にかけて、CHAPSやコール酸ナトリウムを除去し、GTP S前処理-素通り画分は用いなかった。 S前処理-素通り画分は用いなかった。 III実験結果(1)ブタ白血球膜のLTB4Rの性質 結合実験の条件を25℃で1時間とした。ブタ白血球膜はスキャッチャード解析より、Kd=0.246nM、Bmax=1525fmol/mg proteinであった。大量に入手可能で、高親和性のLTB4結合部位を有し、最大結合量も多いことから、以下、ブタ白血球を材料に用いることにした。 (2)ブタ白血球LTB4Rの可溶化及び可溶化画分の〔3H〕LTB4結合活性の測定 ブタ血液10lから2段階のCHAPS処理にて約50mgの可溶化標品を得た。2段階CHAPS処理により、膜表在性のタンパク質が除かれ、1段階の可溶化の場合と比べておよそ2倍の比活性を持ったサンブルが得られ、回収率も変わらなかった。NAP-5ゲル濾過カラムを用いた結合実験では、受容体に結合した〔3H〕LTB4は、見かけ上、大きな分子となるために500〜1300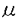 lの画分に溶出された。この画分の放射活性から[3H]LTB4特異的結合能を求めた。 lの画分に溶出された。この画分の放射活性から[3H]LTB4特異的結合能を求めた。 (3)レクチンカラムを用いたブタ白血球LTB4RとGタンパク質との分離 LTB4BはRCA120カラムに吸着し、素通りするGタンパク質画分とlactoseで溶出される受容体画分とに分離された。吸着画分の比活性は780〜960fmol/mgとむしろ低下し、〔35S〕GTP S結合の値は可溶化画分が1.62nmol/mgであるのに対して、吸着画分では0.16nmol/mgと、約1/10になっていた。抗 S結合の値は可溶化画分が1.62nmol/mgであるのに対して、吸着画分では0.16nmol/mgと、約1/10になっていた。抗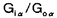 抗体を一次抗体としてウェスタンブロットを行うと、素通り画分が強く染色された。LTB4結合のGTP 抗体を一次抗体としてウェスタンブロットを行うと、素通り画分が強く染色された。LTB4結合のGTP S添加による影響を比較すると、可溶化画分ではlC50=1×10-8Mで阻害を受けたが、吸着画分では1×10-4Mでも影響を受けなかった。以上より、RCA120カラムにより、LTB4RとGタンパク質とが分離したと考えられた。そこで次に、リガンド親和性を回復させるために、分離したGタンパク質との再構成を検討した。 S添加による影響を比較すると、可溶化画分ではlC50=1×10-8Mで阻害を受けたが、吸着画分では1×10-4Mでも影響を受けなかった。以上より、RCA120カラムにより、LTB4RとGタンパク質とが分離したと考えられた。そこで次に、リガンド親和性を回復させるために、分離したGタンパク質との再構成を検討した。 (4)RCA120吸着画分の内在性Gタンパク質との再構成 素通り画分を吸着画分に単に添加してもLTB4結合能は回復しなかった。そこで、素通り画分を遠心濃縮して吸着画分に添加し、NAP-5でCHAPSを除去したところ、LTB4結合能は約5倍に上昇した。また、1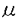 M GTP M GTP sの反応液中への添加によってこの増加効果は消失した。吸着画分にタンパク量比で約3倍強の素通り画分を混ぜると、十分な増加効果が認められた。素通り画分を1 sの反応液中への添加によってこの増加効果は消失した。吸着画分にタンパク量比で約3倍強の素通り画分を混ぜると、十分な増加効果が認められた。素通り画分を1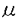 M GTP M GTP Sで前処理しておくと、この増加効果は減弱した。可溶化画分と吸着画分と再構成標品に対して、スキャッチャード解析を行ったところ、可溶化画分ではLTB4の解離定数(Kd)=23.8nM、最大結合量(Bmax)=10.3fmol/mg proteinと高親和性であったが、吸着画分ではKd=500nM、Bmax=78fmol/mg proteinと低親和性になり、再構成標品ではKd=50nM、Bmax=37.9fmol/mg proteinと親和性が可溶化画分の近くまで回復した。 Sで前処理しておくと、この増加効果は減弱した。可溶化画分と吸着画分と再構成標品に対して、スキャッチャード解析を行ったところ、可溶化画分ではLTB4の解離定数(Kd)=23.8nM、最大結合量(Bmax)=10.3fmol/mg proteinと高親和性であったが、吸着画分ではKd=500nM、Bmax=78fmol/mg proteinと低親和性になり、再構成標品ではKd=50nM、Bmax=37.9fmol/mg proteinと親和性が可溶化画分の近くまで回復した。 (5)LTB4Rの外来性のGタンパク質との再構成 この実験系を利用して共役するGタンパク質の種類の検討を行った。 LTB4結合は、吸着画分に単にウシ脳3量体Gi2精製標品を加えても増加しなかったが、GTP S前処理-素通り画分をさらに添加すると増加した。GTP S前処理-素通り画分をさらに添加すると増加した。GTP S前処理-素通り画分自身にはLTB4結合能は認められなかった。 S前処理-素通り画分自身にはLTB4結合能は認められなかった。 バキュロウイルス-Sf9系で発現した各種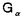 や3量体Gタンパク質可溶化画分を用いて、[35S]GTP や3量体Gタンパク質可溶化画分を用いて、[35S]GTP S結合活性を揃えてLTB4結合を比較検討した。 S結合活性を揃えてLTB4結合を比較検討した。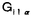 , ,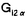 , ,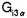 , ,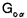 はいずれも同程度に増加効果を示し、各種3量体Gタンパク質(Gi1,Gi2,Gi3,Go)の間でも有意な違いは認められなかった。GTP はいずれも同程度に増加効果を示し、各種3量体Gタンパク質(Gi1,Gi2,Gi3,Go)の間でも有意な違いは認められなかった。GTP S前処理-素通り画分は、 S前処理-素通り画分は、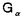 との再構成では必要であったが、3量体Gタンパク質との再構成では存在しなくても増加効果が示された。また、 との再構成では必要であったが、3量体Gタンパク質との再構成では存在しなくても増加効果が示された。また、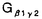 可溶化画分が受容体と 可溶化画分が受容体と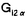 の再構成に及ぼす影響を検討すると、 の再構成に及ぼす影響を検討すると、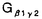 も存在した方が増加効果が増強した。再構成にはGTP も存在した方が増加効果が増強した。再構成にはGTP S前処理で影響を受けない S前処理で影響を受けない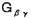 やリン脂質が関与していると考えられた。Gタンパク質に対する抗体を用いたウエスタンブロットより、ブタ白血球にはGi3, やリン脂質が関与していると考えられた。Gタンパク質に対する抗体を用いたウエスタンブロットより、ブタ白血球にはGi3,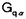 , ,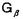 が多く発現し、吸着画分には少量の が多く発現し、吸着画分には少量の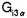 , ,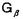 が残存していると判断された。 が残存していると判断された。 (6)LTB4R再構成系の受容体精製への利用 RCA120吸着画分をさらにPhenyl-5PWで精製したあとのサンプルでも、素通り画分を添加することによってLTB4結合が増加した。 IV考察及び結論 1.ブタ白血球膜のLTB4受容体を2段階CHAPS処理で可溶化し、RCA120カラムに通すことにより、Gタンパク質画分と受容体画分に分離することが出来た。 2.RCA120素通り画分をRCA120吸着画分(解離定数Kd=500nM)に添加すると、[3H]LTB4結合能は約5倍に上昇し、親和性も上昇した(Kd=50nM)。これは、吸着画分に存在するLTB4受容体が、素通り画分の内在性のGタンパク質と再構成されたためと考えられた。 3.同様の増加効果は、GTP S前処理をした素通り画分存在下に、ウシ脳3量体Gi2精製標品やバキュロウイルス-Sf9系で発現した S前処理をした素通り画分存在下に、ウシ脳3量体Gi2精製標品やバキュロウイルス-Sf9系で発現した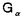 を用いても再現可能であった。素通り画分のGTP を用いても再現可能であった。素通り画分のGTP S前処理によって、内在性の S前処理によって、内在性の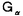 は失活するが、この処理により影響を受けないリン脂質や は失活するが、この処理により影響を受けないリン脂質や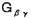 が再構成に必要であると考えられた。 が再構成に必要であると考えられた。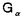 と と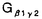 をSf9細胞に共発現させ、コール酸ナトリウムで可溶化した3量体Gタンパク質膜画分を用いた場合は、GTP をSf9細胞に共発現させ、コール酸ナトリウムで可溶化した3量体Gタンパク質膜画分を用いた場合は、GTP S前処理-素通り画分がなくても再構成が可能であった。 S前処理-素通り画分がなくても再構成が可能であった。 4.ブタ白血球のLTB4受容体はバキュロウィルスーSf9発現系の各種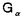 (Gi1,Gi2,Gi3,GO)や各種3量体Gタンパク質(Gi1,Gi2,Gi3,GO)といずれも同程度に再構成され、ブタ白血球のLTB4受容体が、実際に白血球に発現しているGi2やGi3と共役することを確認した。脳などの臓器においては、LTB4受容体がGi1やGOと共役している可能性も示唆された。 (Gi1,Gi2,Gi3,GO)や各種3量体Gタンパク質(Gi1,Gi2,Gi3,GO)といずれも同程度に再構成され、ブタ白血球のLTB4受容体が、実際に白血球に発現しているGi2やGi3と共役することを確認した。脳などの臓器においては、LTB4受容体がGi1やGOと共役している可能性も示唆された。 5.再構成により、Phenyl-5PWなどのカラム精製後のサンプルにおいてもLTB4結合能は増加効果を示した。精製過程でGタンパク質が分離し、受容体が低親和性となっても、内在性またはバキュロウイルス-Sf9発現系のGタンパク質を添加することによって、親和性が回復して結合実験による評価が可能となり、今後の受容体精製に有用であると考えられた。 |
| 審査要旨 | | 本研究は、ロイコトリエンB4(LTB4)受容体と共役するGTP結合制御タンパク質(Gタンパク質)の種類を明らかにすることを目的としている。LTB4は炎症の重要なメディエーターであるが、その受容体は精製されておらず、そのcDNAもクローニングされていない。そこで、ブタ白血球のLTB4受容体と各種Gタンパク質を再構成する方法を開発し、以下の結果を得ている。 1.ブタ白血球膜を界面活性剤CHAPSで可溶化し、可溶化標品を糖タンパク質を吸着するレクチン樹脂(RCA120カラム)に通すことにより、樹脂に吸着するLTB4受容体画分と素通りするGタンパク質画分とに分離することが出来た。 2.RCA120素通り画分をRCA120吸着画分に添加すると、RCA120吸着画分の[3H]LTB4に対する親和性は約10倍増加し、結合の解離定数が500nMから50nMに減少した。素通り画分を非水解性GTP誘導体であるGTP Sで前処理すると、素通り画分のこの効果は失われた。この結果は、吸着画分に存在するLTB4受容体が素通り画分に回収される内在性Gタンパク質と相互作用し、グアニンヌクレオチド不在下にアゴニストに高親和性の受容体・Gタンパク質複合体を形成したことを示唆している。 Sで前処理すると、素通り画分のこの効果は失われた。この結果は、吸着画分に存在するLTB4受容体が素通り画分に回収される内在性Gタンパク質と相互作用し、グアニンヌクレオチド不在下にアゴニストに高親和性の受容体・Gタンパク質複合体を形成したことを示唆している。 3.バキュロウイルスーSf9系で発現し、可溶化分画に回収されるGタンパク質aサブユニットをRCA120吸着画分に添加した場合は、[3H]LTB4の結合促進効果は見られなかった。しかし、GTP S前処理した素通り画分を同時に添加すると[3H]LTB4の結合促進効果が見られた。Gタンパク質 S前処理した素通り画分を同時に添加すると[3H]LTB4の結合促進効果が見られた。Gタンパク質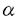 サブユニットとGタンパク質 サブユニットとGタンパク質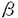 1 1 2サブユニットをSf9細胞に共発現させ、膜標品からコール酸ナトリウムで可溶化した3量体Gタンパク質を用いた場合は、GTP 2サブユニットをSf9細胞に共発現させ、膜標品からコール酸ナトリウムで可溶化した3量体Gタンパク質を用いた場合は、GTP S前処理した素通り画分がなくても[3H]LTB4の結合促進効果が見られた。また、ウシ脳から精製されたGタンパク質Gi2(abg3量体)を添加した場合も、[3H]LTB4の結合促進効果が見られるためにはGTP S前処理した素通り画分がなくても[3H]LTB4の結合促進効果が見られた。また、ウシ脳から精製されたGタンパク質Gi2(abg3量体)を添加した場合も、[3H]LTB4の結合促進効果が見られるためにはGTP S前処理した素通り画分が必要であった。これらの結果は、素通り画分のGTP S前処理した素通り画分が必要であった。これらの結果は、素通り画分のGTP S前処理標品中に存在する内在性リン脂質やGタンパク質 S前処理標品中に存在する内在性リン脂質やGタンパク質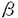  サブユニットがLTB4受容体とGタンパク質aサブユニットの再構成に必要であることを示している。 サブユニットがLTB4受容体とGタンパク質aサブユニットの再構成に必要であることを示している。 4.バキュロウイルス-Sf9発現系で発現させた、各種Gタンパク質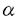 サブユニットあるいは3量体型Gタンパク質、Gi1,Gi2,Gi3,Goは、いずれも同程度に[3H]LTB4の結合を促進する効果を持っていた。この結果は、ブタ白血球のLTB4受容体が、実際に白血球に発現しているGi2やGi3と共役することを示唆している。また、脳などの臓器においてはLTB4受容体がGi1やGoと共役する可能性が考えられる。 サブユニットあるいは3量体型Gタンパク質、Gi1,Gi2,Gi3,Goは、いずれも同程度に[3H]LTB4の結合を促進する効果を持っていた。この結果は、ブタ白血球のLTB4受容体が、実際に白血球に発現しているGi2やGi3と共役することを示唆している。また、脳などの臓器においてはLTB4受容体がGi1やGoと共役する可能性が考えられる。 5.内在性またはバキュロウイルス-Sf9発現系のGタンパク質の添加によって[3H]LTB4の結合親和性を高める実験系が確立されたので、LTB4受容体の精製の際の受容体画分を追跡するのに有用と考えられる。 以上、本研究はLTB4受容体の共役するGタンパク質の種類を再構成により初めて確認したものであり、学位の授与に値すると認められる。 |