不妊症治療におけるIVF-ETの妊娠率は、15-20%であると報告されている。IVF-ETの不成功例の原因の解明は極めて困難である。受精、卵割が良好な例、化学的妊娠が成立する症例などにおいても不成功例が多く存在することから、胚移植後の着床浸潤過程は極めて重要な問題が残されていると考えられる。哺乳類における着床浸潤過程の細胞生物学的、分子機構の解明は、IVF-ETの成績向上に寄与するものと考えられる。哺乳類における胚が子宮内膜に対する着床の細胞学的プロセスは、初期接着期、後期接着期、浸潤期の3段階に分類される。これらの現象は、細胞生物学的に非常に複雑な過程であり、特に浸潤期での失敗は、着床の不成功につながると考えられる。しかし、この推察を証明した実験は報告されていない。In vitroにおける着床浸潤過程の実験系は、非常に困難であるため、舘らは、胚側の浸潤過程のモデルとして、trophoblast spreadingを解析するにふさわしいin vitro培養系を開発した。我々は、この系に更にtime-lapse video recordingを導入することにより、trophoblast spreadingに伴う時間的、定量的、形態学的解析を行った。また、trophoblast spreadingに遺伝的な制御に関して異なるマウス種を用いて検討した。 まず、ICR系マウスを用いて過排卵処理、交配後、胚盤胞を回収し培養に供した。マウス胚盤胞の基本培養液は、改変MEMにCMRL1066を混合し20%FBSを添加したものを用いた。培養皿上のクォーツリング内に培養液を入れ、採取した胚盤胞を37℃、5%CO2の条件下で培養を行った。断続的に培養開始から24、48、72、96、120時間で、培養器よりdishを取り出してtrophoblast spreadingを撮影し、その面積をdigitizer tablet Model DT1000により定量した。Trophoblast outgrowthの表面積は、培養24-96時間において面積は直線的に増加した。(図1) 次に、trophoblast spreadingの細胞生物学的過程を時間的、定量的、形態学的評価を行うためにtime-lapse video recordingを行った。倒立顕微鏡上に設置した培養チャンバー内にculture dishを固定し、画像は、顕微鏡に接続したtime-lapse video recorder BR-9060を用いて1 frame/4秒で撮影した。trophoblast spreaingの表面積は、2時間ごとにプロットし同様に定量した結果、直線的増加を示した。(図2) 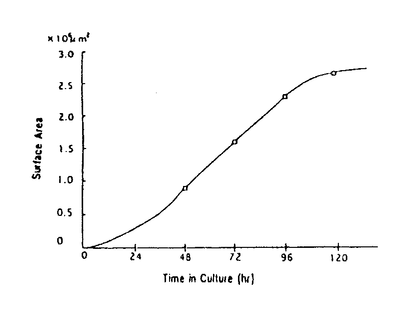 図1 図1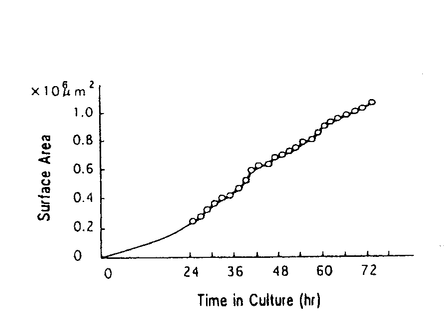 図2 図2 Trophoblast spreaingの細胞動態の経時的変化は、培養24時間後より開始した。観察開始時、胚盤胞は、既に透明帯からhatchし底面に接着している。Trophoblastの断端に顕著な波状運動が認められるが、細胞自体の移動は観察されない。Trophoblast細胞は、26時間後から緩徐に移動し、32時間後には胚盤胞外周全域に至る。その後、移動したTrophoblast細胞からgiant trophoblastの形成が認められた。Giant trophoblast細胞は、trophoblast細胞の中でヒトには存在しない細胞で巨核、巨大な細胞として知られている。内部細胞塊は、40時間後より増大が明らかとなり、48-52時間にはその分化が認められる。54時間後、内部細胞塊の内胚葉、原始外胚葉の2層への分化は明確となり、同時に発達した外胎盤錐が形成される。外胎盤錐は、胎盤原基として知られている。この外胎盤錐の細胞領域では、活発な細胞増殖と細胞移動が観察された。Trophoblast spreadに伴い、外胎盤錐の細胞の一部が、trophoblast spreadの断端に移動し、giant trophoblast cellへの分化が観察された。これら伸展過程においてtrophoblast cellsの大きさと数は顕著に増加したが、trophoblast spreadingの外形に変化はほとんどなく、胚周囲全体にわたって、直径は緩徐な増加を示した。Time-lapse video recordingから観察されたように、trophoblast spreadingは、主に以下にあげる4っの細胞生物学的過程から構成される。1、トロフォブラスト細胞の移動。2、トロフォブラスト細胞からGiant cellの形成。3、外胎盤錐細胞の増殖。4、外胎盤錐細胞からsecondary giant cellの形成。トロフォブラスト細胞の移動の過程においては、トロフォブラスト細胞とsubstratumの相互作用で起こる細胞膜の波状運動が認められ、その後樹状突起状の伸展がみられる。In vitro系の他の細胞において、細胞の波状運動や樹上突起状の伸展様式はこれまでにも観察されている。 Trophoblast spreadingのoutgrowthの平均は、48-96時間において直線的増加を示し、outgrowthの外形は、胚盤胞全周にわたり等しくおこり、spreadの周囲への直線的な移動速度は、培養が進行するほど小さくなることがわかった。以上の結果よりトロフォブラスト細胞の伸展過程には、Giant cellの形成が非常に重要な要素であると考えられるので、連続観察した外胎盤錐からGiant cellの形成過程について検討した。Giant cellの面積は、外胎盤錐の細胞として出現してから増大を停止するまでに約8倍となった。また、核細胞質面積比は、外胎盤錐細胞として認識されてから10時間の間に0.05から0.35に増加した。その後、核は増大を停止し、細胞質が増大するので核細胞質比は、やや減少するが、培養60時間後には横ばいとなった。(図3, 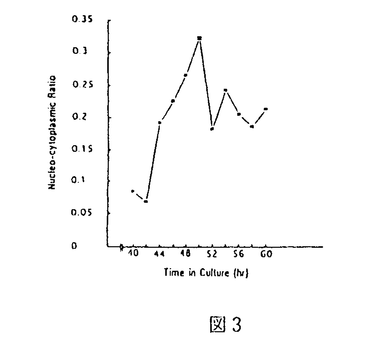 図3 図3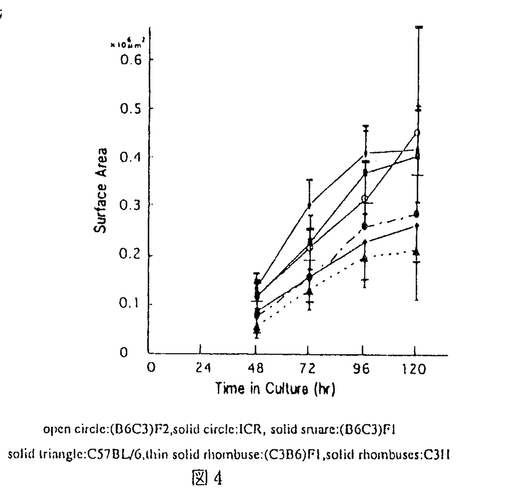 図4open circle:(B6C3)F2,solid circle:ICR,solid sniare:(B6C3)F1 solid triangle:C57BL/6,thin solid rhombuse:(C3B6)F1,solid rhombuses:C3H 図4open circle:(B6C3)F2,solid circle:ICR,solid sniare:(B6C3)F1 solid triangle:C57BL/6,thin solid rhombuse:(C3B6)F1,solid rhombuses:C3H 次に、マウス種差によるtrophoblast outgrowthの遺伝的制御に関して検討した。ICR、C57BL/6、C3H、(B6×C3)F1、(C3×B6)F1、(B6×C3)F2の遺伝的バックグラウンドの異なるマウスのおいてTrophoblast outgrowthを24時間毎に撮影し定量的に解析した。結果は、図に示すように、trophoblast outgrowthには、明らかに遺伝的差が現れた。F1、F2の胚盤胞は、純系の胚盤胞に比較して、trophoblast outgrowthの増加率が顕著に大きいことが明らかになった。特に、(B6×C3)F1が最も大きく、純系C57BL/6が最も小さい結果となった。(図4) Trophoblast spreadの詳細な連続観察により、outgrowthの過程は、2っの相から構成されることがわかる。第一相は、培養38-40時間後、樹上突起状の伸展が終了しその外形が、ほぼ滑らかになる過程であり、表面積の増加率は徐々に遅くなる。次の第二相は、外胎盤錐からの細胞の移動またgiant cellの形成によってtrophoblastが伸展していく過程である。Trophoblast spreadでは、Giant cellの形成が重要な要素であり、形態学的変化を連続的に観察した。この過程で、外胎盤錐細胞は、約8倍に増大し、外胎盤錐の核細胞質比は、培養40-46時間の間に直線的に増加した。この間に、これらの細胞の核の核内複製が起きているものと推察される。培養50-51時間で、急激に細胞質が増大し、核細胞質比は減少することより、核の核内複製が先行し、後に細胞質の急激な増大が続いているものと思われる。このように、Giant cell transformationは、trophoblast spreadingに伴う細胞変化の中で最も重要な要因であるにもかかわらず、その機構に関してはほとんど解明されていないが、IGF-1が外胎盤錐の増殖と移動を促進し、IGF-2がtrophoblast cellからGiant cellへの形質転換を助長するという報告もある。しかし、この研究は、妊娠10.5日の子宮から回収した外胎盤錐細胞を用いているものである。今回の初期のtrophoblast outgrowthには、異なった成長因子が関与している可能性が考えられる。 また、今回、遺伝的なバックグラウンドの異なった胚盤胞においては、そのtrophoblast spreadingの速度に差が認められると言う興味深い結果が得られた。雑種(B6×C3)において最も大きく、純系B6において最も小さい結果となった。マウスの種差による初期胚分割速度についての遺伝的相違は報告されているが、trophoblast outgrowthで遺伝的差を報告しているものはない。今回の培養系においても、培養96-120時間でtrophoblast outgrowthは、横ばいに達しそれ以上の伸展を見せない。実際のin vivoにおいてその後のspreadにcatch upが成立している可能性は否定できないが、少なくとも、初期浸潤期としてのtrophoblast spreadingにおける遺伝的制御の存在を強く示唆するものである。着床浸潤のin vitroモデルとしてtrophoblast outgrowthを遺伝的に制御する機構の追求は、着床初期におけるトロフォブラスト浸潤の分子機構を解明するに重要だと思われる。また、同時にIVF-ETの成功率の向上に寄与するものと考えられる。 |