学位論文要旨
| No | 112835 | |
| 著者(漢字) | 川戸,明広 | |
| 著者(英字) | ||
| 著者(カナ) | カワト,アキヒロ | |
| 標題(和) | 腱切断後の低緊張による骨格筋変性に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 112835 | |
| 報告番号 | 甲12835 | |
| 学位授与日 | 1997.03.28 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1205号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 外科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 筋肉が萎縮する原因としては、脱神経denervation,あるいは筋不動immobilzationによる廃用性萎縮、腱切断による低緊張性萎縮、さらに筋ジストロフィーや各種ミオパチーといった筋原性の疾患などが挙げられる。筋変性疾患である進行性筋ジストロフィーではジストロフィンの欠損により、筋線維の壊死と再生が繰り返され筋肉全体として萎縮に向かう。腱切断による筋萎縮過程はこういった疾患とどのように異なる過程をたどるのであろうか。腱切断で萎縮に陥った筋線維は壊死するのであろうか、また壊死に引き続く筋線維の再生がみられるのであろうか、あるいは別の形で筋全体の回復が起こるのであろうか。筋の萎縮に伴い筋細胞核の数も減少するのであろうかなどと、いまだ結論が得られていない問題が多く残されている。近年、多発性筋炎などの筋原性疾患において核のアポトーシス様変化(Fas 抗原発現など)が観察された。腱切断後などの筋萎縮過程においてもこうした現象が認められるかについては報告はない。 本研究では、低緊張性筋萎縮において、虚血性変化のように筋線維の壊死およびそれに引き続く筋再生が見られるのか、筋アポトーシスは誘発されるのか、細胞のターンオーバーは起こっているのか、回復の過程があるとしたらどのように行われているのか、そして筋衛生細胞は萎縮過程においてどう関わっていくのかなどを明らかにするために、腱切断後の筋肉を経時的にいくつかのアプローチを用いて総合的に観察した。 ミオシンH鎖は大きく分けて4種類あり、ラットでは胎児期はembryonic H鎖、新生児期はneonatal(fetal)H鎖を生じ、やがてadult type(fastまたはslow)へと発生、成長の経過とともに変化するが、筋の再生過程においても発生段階と同様にembryonicやneonatal H鎖という幼若なミオシンH鎖が現れることが明らかになっている。著者は、各種ミオシンH鎖に対するモノクロナール抗体、さらにはBrdUやMyoDなどに対する抗体を用いて、筋肉を構成している筋線維タイプの変化、筋再生・修復の有無を調べた。 Wistar系ラット雄73匹のアキレス腱切断モデルを作成した。モデルはひらめ筋の起始部を残し、停止部を切断、ひらめ筋の支配神経のみ残して他の神経は切断し作成した。モデル作成後、2日、4日、7日、2週、4週後に、BrdU注射した後等尺性収縮力を測定した。ラット大腿骨遠位部を測定台に固定し、アキレス腱をトランスデューサーのプローブに結紮、坐骨神経に電極を当て刺激しコンピューターとオシロスコープで解析した。単一パルスでのisometric twitch tensionを測定しながら、筋体長を徐々に変えて、maximum isometric twitch tensionを求めた。これと同じ筋長で連続パルスを加えパルス周波数を漸増して、maximum isometric tetanic tensionを求めた。さらに単位生理学的断面積あたりの最大等尺性収縮力であるspecific forceを求めた。 組織標本はHE、Gomori変法染色、NADH-TR染色の他、ミオシンアイソフォームの変化や筋再生を見るため、fast,slow,embryonic myosin H鎖の各モノクロナール抗体染色を行なった。さらに筋衛星細胞の活動性を見るためMyoDのモノクロナール抗体染色,BrdUのモノクロナール抗体染色をおこなった。 アポトーシスの検出には、TdT-mediated dUTP-biotin nick end labeling(TUNEL法)でDNAfragmentの末端標識を行い、それに加えてアガロースゲル電気泳動法、ならびに核DNAfragmentationにより核外に遊離したヌクレオソームを検出する遊離ヌクレオソーム検出ELISA法を行った。 筋線維の形態学的変化としてひらめ筋の筋体長は腱切断後著しく短縮し、正常で31.05±1.49mm(平均値±標準偏差)が2日後25.44±1.85mm(対照群の82%)と最も短縮し(P<0.01)、その後は有意な変化はない。筋湿性重量は腱切断後より減少し正常で192.71±19.97mgが2週目で145.25±30.36mg(正常対照群の75%)と最小となり、その後4週頃には回復に向かっている。Cross sectional areaは筋体長の減少と間質水分量の増加もあり、9.79±1.22mm2が2日目で12.74±3.03mm2(正常対照群の130%)と最も増加し(p<0.01)、その後減少する(p<0.05)。筋萎縮は1週間目が最も強く、NADH-TR染色で筋線維中心部に筋原線維変性(core lesion)が認められた。筋線維直径はslow fiberで正常で46.6±7.7 等尺性収縮力はmaximum isometric twitch tension、maximum isometric tetanic tensionともに腱切断後1週目で最も低下し、それぞれ正常で497.44±102.16mNが218.67±78.22mN(正常対照群の43%,p<0.01)、2047.80±283.55mNが1367.84±450.00mNと(正常対照群の67%,p<0.01)と低下している。Specific forceも正常で210.04±23.32kN/m2が1週目で最も低下し137.42±43.50mN(正常対照群の65%,p<0.01)になっている。 TUNEL法では2日、4日目においてアポトーシス同様の筋細胞の核DNA断片化が検出された。遊離ヌクレオソーム検出ELISA法でも、発色過程を20分とし10倍希釈溶液の吸光度を測定したところ、正常で0.516±0.056O.D.であった吸光度が2日、4日でそれぞれ1.156±0.111,1.241±0.112O.D.となり同じく遊離ヌクレオソームが増加していることが観察された。しかし、アガロースゲル電気泳動法ではラダーは断片化DNAが少量であるため検出されなかった。一方、2日目以降にBrdU陽性の筋衛星細胞核が認められる。4日目よりMyoD 1陽性の筋衛星細胞がみとめられた。4日目、1週目でembryonic myosinで濃染する小型の筋線維が見られ、2週頃に周辺部がembryonic myosinで淡染する筋線維の出現が見られる。 腱切断モデルでは低緊張により筋線維の萎縮が起こる。筋体長、筋湿性重量、筋線維直径の減少が1週目位を中心として起っており、この時期、筋線維中心部に強い筋原線維の萎縮性変性(core lesion)が認められた。Shafiqらは腱切断後のヒラメ筋筋線維の中心部にcore lesionのほか、ミトコンドリア変性、nemaline小体を認めると報告しているが、本研究では筋線維中心部のcore lesionは認められたものの、nemaline小体は認められず1週目以降ragged red fiberが認められた。つまり、ミトコンドリアが増え代謝が活発になった筋線維の存在が認められた。 ミオシンアイソフォームについてはembryonic myosin,fast myosinの増加が4日目ころより見られた。虚血、筋ジストロフィー等で筋肉の再生が起こる時も通常の筋発生、成長時と同様にembryonic myosin→neonetal myosin→fast myosinまたはslow myosinという順でミオシンが出現する。腱切断後の筋線維の場合も同じ順でミオシンが出現すると考えられるが、本研究の結果より、低緊張で再生は起っているのかというとごく一部には起っているかもしれないが、萎縮した筋線維の周辺部にembryonic myosinが出現していることより、活性化された筋衛星細胞が既存の萎縮筋線維に癒合し修復が起っていると考えられる。 ヒラメ筋の等尺性収縮力を測定したが、1週目でmaximum isometric twitch tensionが43%に、maximum isometric tetanic tension67%に、ともに最も低下する。Maximum isometric tetanic tensionを生理学的断面積で割ったspecific forceは1週目には65%と最も低下している。Maximum isometric tetanic tensionの減少と筋線維直径の減少は相関しているが、maximum isometric tetanic tensionの方が減少が著しい。これは筋肉の量的変化のみならず質的変化も起っていることをあらわしており、質的変化を表すspecific forceはやはり低下している。Maximum isometric tetanic tension、specific forceともにヒラメ筋線維の萎縮の強い1週間位を中心に低下しており、この時期に筋線維中心に強い筋原線維の萎縮性変性が見られる。筋の質的変化として筋線維直径の減少などといった収縮要素の減少と、間質水分量の増加や結合織の増加といった非収縮要素の増加が考えられる。またmaximum isometric tetanic tensionよりmaximum isometric twitch tensionの方が減少割合が大きいが、前者は緩徐な収縮のため間質水分量が増すと低下すると考えられ、後者は急激な収縮のため間質水分量のほかに、線維性結合織が増しても低下すると考えられる。つまり、間質水分量がひらめ筋筋断面積の約33%に増加し、結合織増加により最大で筋収縮力が約24%減少すると考えられる。筋線維が縮小するのに先立ち、アポトーシス同様の核DNA断片化が起り核が崩壊している。核DNA断片化が起これば単核細胞ではアポトーシス、つまり細胞死を起すが、多核である筋細胞ではいくつか核が崩壊しても残りの核があるので生き続ける。ただし、タンパクの合成が減ることになるので筋線維直径は減少すると考えられる。 一方、少し時期が遅れて筋衛星細胞が活性化されるのが、BrdUモノクロナール染色により分かる。休止していた筋衛星細胞が活動を始め筋線維に癒合することにより、筋線維直径が回復してくると考えられる。筋衛星細胞の活性化は壊死線維においては浸潤してきたマクロファージの分泌するtrophic factorにより筋衛星細胞は活性化されるが、細小化したまた筋線維の場合マクロファージの浸潤は認められない、そのためマクロファージ由来ではない別のtrophic factorにより、恐らくはDNA fragmentそのものにより筋衛星細胞が活性化される可能性が考えられる。1週頃より筋衛星細胞が働き始めていることが、MyoDl陽性線維が見られたことにより判る。成長時には筋芽細胞が活動し癒合することにより一次筋管細胞、二次筋管細胞ができ、やがてそれらが筋線維となっていくが、低緊張性萎縮の場合、筋芽細胞が既存の萎縮した筋線維に癒合し、筋線維を修復するのに貢献していると考えられる。 筋衛星細胞は不測の事態に備え通常は休止状態にあるが、必要に応じて筋線維を再生するか、もしくは細くなった筋線維に癒合して筋線維を修復する。腱切断による低緊張状態で筋は萎縮を起す。萎縮初期には、アポトーシスに見られる核DNAfragmentationを起こし、いくつか核が崩壊し、核の数を減らすことにより結果的に筋線維直径の縮小が起こると考えられる。ただ通常のアポトーシスと異なるのは、筋細胞が多核であるため筋線維全体としては細胞死には至らず細小化するだけである。筋線維の萎縮の一方で、筋肉は低緊張に順応し、筋線維の修復が起こると考えられる。眠れる筋衛星細胞は活性化され分裂増殖し、細くなった筋線維に癒合し、新たな筋細胞の核として働きはじめ、embryonic myosin等の筋特異的蛋白を産生し筋線維が再び肥大する、つまり、筋線維の壊死・再生ではなく核の崩壊、萎縮、修復が起っていると考えられる。 | |
| 審査要旨 | 本研究は筋肉移植時における筋萎縮の原因の一つである低緊張性の骨格筋萎縮変性過程を明らかにするため、ラットのアキレス腱を切断し、経時的にひらめ筋の等尺性収縮力測定とミオシンや筋修復に関わる筋蛋白の免疫組織化学的染色を試みたものであり、下記の結果を得ている。 1.アキレス腱切断によりひらめ筋は急激にその筋体長を短縮し、筋線維直径の減少などの萎縮性変化を起した。 2.腱切断後1週目頃が最も萎縮変性が強く、中心部に筋原線維のcore状変性を生じるほど強い萎縮を起しており、ミトコンドリア変性、ragged red fiberの出現が起った。電子顕微鏡的には筋線維中心部で筋原線維の走行の乱れ、Z-diskの肥厚と高密度化、ミトコンドリアの増加と集簇がみとめられた。 3.ミオシンについては、embryonic myosin、fast myosinが経過途中で増加し、slowmyosinは相対的に減少した。壊死線維とは異なって既存の萎縮した筋線維の周辺部にembryonic myosinの出現しているものもあり、活性化された筋衛星細胞が既存の萎縮筋線維に融合し修復が起っている可能性が示唆された。このことは、透過電顕像においても確認できた。 4.ひらめ筋等尺性収縮力については、1週目でcross sectional areaは正常対照群の3%増加とほとんど変わらないにもかかわらずM.tetanusで33%もの減少が起っており、筋の質的低下と考えられ、これをあらわすspecific forceは35%の減少を示した。specific force低下の原因は、間質水分量の増加による収縮要素の減少と、収縮を妨げる線維性結合織などの非収縮要素の増大であると考えられた。specific forceは2週目以降徐々に回復に向かうがこれはoptimum lengthを維持するためにsarcomere数を減らすという筋肉の低緊張への順応と筋修復による筋線維直径の回復によるものと考えられる。 5.筋萎縮の初期に筋線維はTUNEL法陽性核と細胞内遊離ヌクレオソームの増加が見られ、アポトーシスに見られるのと同様のDNA fragmentationを起しいくつか核が崩壊した可能性が考えらる。核の数が減少したことにより結果的に筋線維の縮小が起ったと考えられる。ただ、通常のアポトーシスと異なるのは、筋細胞が多核であるため筋線維全体としては細胞死には至らず細小化すると考えられる。 6.低緊張状態に陥った筋肉は直ちに萎縮しはじめるが、一方では筋線維は低緊張に順応し、修復を開始すると考えられる。マクロファージの浸潤は修復過程中認められないので休止状態にある筋衛星細胞はマクロファージ由来のtrophic factorではなく、何か別のtrophic factorにより活性化されと考えられる。trophic factorとしてはDNA fragment等の可能性も考えられ今後の研究に期待される。 7.筋衛星細胞は不測の事態に備え通常は休止状態にあるが、必要に応じて筋線維を再生するか、もしくは細くなった筋線維に融合して筋線維を修復すると考えられる。低緊張では活性化筋衛星細胞は細くなった筋線維に融合し分裂増殖しMyoDlproteinを産生するとともに筋線維を合成しはじめると考えられる。筋線維辺縁でのMyoDl陽性領域は経過中増大しているので、これは既存の萎縮筋線維に筋衛星細胞が融合し修復が起っていることを示唆する。電子顕微鏡像でも既存筋原線維への筋衛星細胞の融合が見られた。 8.筋肉移植の場合、低緊張により骨格筋は萎縮を起すので前腕屈筋群のように張力を必要とする場合はかなり張力をつけて移植する必要があるが、顔面神経麻痺の遊離筋肉移植のような筋力をあまり必要としない場合は中程度の張力でよいと思われる。 以上、本論文はラットひらめ筋の低緊張性萎縮変性を等尺性収縮力の観点からと、免疫組織化学的観点とから見たのもで、筋収縮力が最も低下する腱切断後1週目では筋線維中心部のcore状変性が起っており、筋線維の萎縮の開始に核DNAfragmentationが、修復の開始に既存筋線維への筋衛星細胞の融合の可能性が考えられる。本研究は、これまで未知に等しかった低緊張性萎縮時の萎縮起点と修復起点の可能性を示し、筋肉の萎縮修復過程の解明と筋肉移植時の萎縮の予防とに重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/53963 |
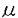 mが1週目に43.4±8.7
mが1週目に43.4±8.7