| はじめに イノシトールリン脂質(PI)3-キナーゼは、イノシトール環の3位の水酸基をリン酸化する脂質キナーゼであり、細胞を増殖あるいは分化へと導く細胞内の情報伝達系において、重要な役割を果たすと考えられている。インスリン受容体に代表されるチロシンキナーゼ型受容体を介した情報伝達経路では、110-kDa触媒サブユニット(p110)と85-kDa活性調節サブユニット(p85)からなるヘテロダイマー型PI3-キナーゼ(p110/p85)が活性化される。この場合、p85に含まれるSrc homology(SH)2ドメインとYMXMモチーフ中のリン酸化チロシンの結合がこの酵素の活性化の引き金になる。また、このタイプの触媒サブユニットに関しては、コードする2種のcDNA、p110 とp110 とp110 がすでに単離されているが、両触媒サブユニットの活性制御機構の違いに関する報告はない。 がすでに単離されているが、両触媒サブユニットの活性制御機構の違いに関する報告はない。 また最近では、G蛋白質共役型受容体を介した情報伝達経路においても、PI3-キナーゼの関与が報告され、その下流においてp70S6キナーゼやMAPキナーゼが活性化されることが報告されている。これとは別に、既知の触媒サブユニットとのホモロジーにより単離されたp110 がin vitroにおいて三量体型G蛋白質によって活性化されることが示されたが、このp110 がin vitroにおいて三量体型G蛋白質によって活性化されることが示されたが、このp110 が受容体刺激に伴って実際に活性化されるという証拠はなく、一方で、既知のPI3-キナーゼのdominant negative体がG蛋白質共役型受容体を介したMAP-キナーゼの活性化を抑制することなどから、調節サブユニットをもつヘテロダイマー型PI3-キナーゼが、G蛋白質によって制御されているという見解もあり、G蛋白質に対して直接感受性を示すPI3-キナーゼの実体とその活性調節機構に関しては未解明な状況である。そこで、G蛋白質共役型受容体を介して活性化されるPI3-キナーゼの実体を明らかにすることは、その制御機構およびPI3-キナーゼ以降の情報伝達経路を解明するために重要であると考え、G が受容体刺激に伴って実際に活性化されるという証拠はなく、一方で、既知のPI3-キナーゼのdominant negative体がG蛋白質共役型受容体を介したMAP-キナーゼの活性化を抑制することなどから、調節サブユニットをもつヘテロダイマー型PI3-キナーゼが、G蛋白質によって制御されているという見解もあり、G蛋白質に対して直接感受性を示すPI3-キナーゼの実体とその活性調節機構に関しては未解明な状況である。そこで、G蛋白質共役型受容体を介して活性化されるPI3-キナーゼの実体を明らかにすることは、その制御機構およびPI3-キナーゼ以降の情報伝達経路を解明するために重要であると考え、G  による活性化を指標にラット肝臓細胞質画分よりG による活性化を指標にラット肝臓細胞質画分よりG  感受性PI3-キナーゼの精製を試み、その特性の解析を行った。 感受性PI3-キナーゼの精製を試み、その特性の解析を行った。 その際、まず第一に未知のG蛋白質感受性PI3-キナーゼの触媒サブユニットを検出する手法として、PI3-キナーゼの強力な阻害薬であるワートマニンの放射標識誘導体を用いる実験系を開発した。 1.[125I].標識-wortmannin誘導体によるPI3-キナーゼ触媒サブユニットの検出 真菌代謝産物であるwortmanninは、PI3-キナーゼの触媒サブユニットであるp110に共有結合することにより、低濃度でその酵素活性を抑制すると考えられているが、この特性は、放射標識-wortmanninがPI3-キナーゼの触媒サブユニットを同定するための有用なツールになり得る可能を示唆している。そこで、[125I]標識-wortmannin誘導体(Fig.1A)を合成し、この化合物を用いたPI3-キナーゼの触媒サブユニットの検出を試みた。ラット肝臓細胞質画分より、p85に対する抗体を用いて免疫沈降した標品に対してこの化合物の結合実験を行うと、SDS-PAGE上で約110-kDaのPI3-キナーゼの触媒サブユニットに放射標識体の取り込みが見られた。また、wortmanninおよび他のPI3-キナーゼ阻害剤として報告されたLY294002によって前処理した標品に対して同様の実験を行うと、110-kDaへの放射活性の取り込みは抑制された(Fig.1B)。この結果は、[125I]標識-wortmannin誘導体がPI3-キナーゼの触媒サブユニットの検出に有用であることを意味している。 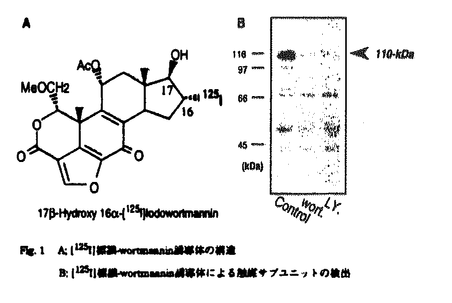 Fig.1A;[125I]標識-wortmannin誘導体の構造 B;[125I]標識-wortmannin誘導体による触媒サブユニットの検出2.ラット肝臓細胞質画分からのG Fig.1A;[125I]標識-wortmannin誘導体の構造 B;[125I]標識-wortmannin誘導体による触媒サブユニットの検出2.ラット肝臓細胞質画分からのG  感受性PI3-キナーゼの精製 感受性PI3-キナーゼの精製 これまでに様々な臓器よりp110/p85は精製されているが、その際用いられた基質はPIであり、生体内において重要と考えれているPI(4,5)P2を基質として精製を行った報告はない。そこで、PI(4,5)P2を基質とし、G  による活性化を指標にG による活性化を指標にG  感受性PI3-キナーゼの精製を試みた。精製はラット肝臓細胞質画分を出発材料としDEAE Sepharose、Q Sepharose、Sephacryl S-300、Resource S、Hydroxylapatite、Mono Q、Mono Sカラムの各カラムクロマトグラフィーの順に行った。しかしながら、一連のカラムクロマトグラフィーによりこの活性を単一標品にまで精製することはできなかった。そこで最終段階のMono Sカラムクロマトグラフィーにより分画された標品に対して、[125I]標識-wortmannin誘導体を用いて触媒サブユニットの検出を試みたところ、110-kDa付近の放射活性をもつバンド(Fig.2A inset)と、G 感受性PI3-キナーゼの精製を試みた。精製はラット肝臓細胞質画分を出発材料としDEAE Sepharose、Q Sepharose、Sephacryl S-300、Resource S、Hydroxylapatite、Mono Q、Mono Sカラムの各カラムクロマトグラフィーの順に行った。しかしながら、一連のカラムクロマトグラフィーによりこの活性を単一標品にまで精製することはできなかった。そこで最終段階のMono Sカラムクロマトグラフィーにより分画された標品に対して、[125I]標識-wortmannin誘導体を用いて触媒サブユニットの検出を試みたところ、110-kDa付近の放射活性をもつバンド(Fig.2A inset)と、G  によって活性化されるPI3-キナーゼの溶出パターンが一致していた(Fig.2A)。そこで、110-kDaの触媒サブユニットのサブタイプである、p110 によって活性化されるPI3-キナーゼの溶出パターンが一致していた(Fig.2A)。そこで、110-kDaの触媒サブユニットのサブタイプである、p110 、 、 、および 、および に対する抗体を用いてこの標品に対してイムノブロットを行ったところ、p110 に対する抗体を用いてこの標品に対してイムノブロットを行ったところ、p110 に対する抗体のみが110-kDaの蛋白質を認識し、その認識のパターンとG に対する抗体のみが110-kDaの蛋白質を認識し、その認識のパターンとG  感受性PI3-キナーゼの溶出パターンは完全に一致していた(Fig.2B)。そこで、この110-kDaの蛋白質のN末端アミノ酸配列の決定を行ったところ、Fig.3に示したように、スレオニンと判定不能だった1つのアミノ酸以外は、humanp 110 感受性PI3-キナーゼの溶出パターンは完全に一致していた(Fig.2B)。そこで、この110-kDaの蛋白質のN末端アミノ酸配列の決定を行ったところ、Fig.3に示したように、スレオニンと判定不能だった1つのアミノ酸以外は、humanp 110 の10番目から27番目のアミノ酸配列と一致した。この結果と、先に用いた抗p110 の10番目から27番目のアミノ酸配列と一致した。この結果と、先に用いた抗p110 抗体のエピトープがhuman p110 抗体のエピトープがhuman p110 のC末端であることから、G のC末端であることから、G  感受性PI3-キナーゼの触媒サブユニットは、p110 感受性PI3-キナーゼの触媒サブユニットは、p110 あるいはp110 あるいはp110 に相同性の高い分子という結論を得た。 に相同性の高い分子という結論を得た。  Fig.2A;Mono SカラムクロマトグラフィーによるG Fig.2A;Mono SカラムクロマトグラフィーによるG  感受性PI3-キナーゼの分離 B;イムノブロットによる触媒サブユニットの検出 C;イムノブロットによる調節サブユニットの検出 感受性PI3-キナーゼの分離 B;イムノブロットによる触媒サブユニットの検出 C;イムノブロットによる調節サブユニットの検出 Fig.3G Fig.3G  感受性PI3-キナーゼ触媒サブユニットのN末アミノ酸配列の決定 感受性PI3-キナーゼ触媒サブユニットのN末アミノ酸配列の決定 ところで、p110 は、すでにそのcDNAが単離されており、p85と結合することが知られている。そこで、Mono Sによって分画されたフラクションに対して、抗p85抗体を用いてイムノブロットを行ったところ、意外なことに、46-Daの蛋白質のみが認識され、この認識のパターンとG は、すでにそのcDNAが単離されており、p85と結合することが知られている。そこで、Mono Sによって分画されたフラクションに対して、抗p85抗体を用いてイムノブロットを行ったところ、意外なことに、46-Daの蛋白質のみが認識され、この認識のパターンとG  感受性PI3-キナーゼの溶出パターンは一致していた(Fig.2C)。さらにG 感受性PI3-キナーゼの溶出パターンは一致していた(Fig.2C)。さらにG  感受性PI3-キナーゼ精製標品からの抗p85抗体用いた免疫沈降標品を銀染色したところ、110-kDaと46-kDaの蛋白質がほぼ1:1の比率で特異的に沈降された。ここまでのの結果はG 感受性PI3-キナーゼ精製標品からの抗p85抗体用いた免疫沈降標品を銀染色したところ、110-kDaと46-kDaの蛋白質がほぼ1:1の比率で特異的に沈降された。ここまでのの結果はG  感受性PI3-キナーゼがp110 感受性PI3-キナーゼがp110 と46-kDaの調節サブユニットからヘテロダイマー型であることを示唆するものである。 と46-kDaの調節サブユニットからヘテロダイマー型であることを示唆するものである。 3.p110 /p46ヘテロダイマー型PI3-キナーゼの性状解析i)46-kDa活性調節サブユニットの性状 /p46ヘテロダイマー型PI3-キナーゼの性状解析i)46-kDa活性調節サブユニットの性状 活性調節サブユニットと考えられる46-kDa蛋白質の性状を、Fig.5Aに示した既知の活性調節サブユニットであるp85に対する3種類の抗体を用いて検討した。ラット肝臓より精製したp110 /p85の調節サブユニットが、全ての抗体によって認識されたのに対して(Fig.4B lane 1)、p46はSH2ドメインに対する2つの抗体によって認識されたが、N末のSH3ドメイン付近を認識する抗体では認識されなかった(Fig.4B lane 2)。今回の精製ではこのp46の実体を示すことはできなかったが、Fig.4の結果は、p46が最近単離されたp85の中央とC末に存在する2つのSH2ドメインを含んだ55-kDaの調節サブユニットのサブタイプである可能性を示唆するものである。 /p85の調節サブユニットが、全ての抗体によって認識されたのに対して(Fig.4B lane 1)、p46はSH2ドメインに対する2つの抗体によって認識されたが、N末のSH3ドメイン付近を認識する抗体では認識されなかった(Fig.4B lane 2)。今回の精製ではこのp46の実体を示すことはできなかったが、Fig.4の結果は、p46が最近単離されたp85の中央とC末に存在する2つのSH2ドメインを含んだ55-kDaの調節サブユニットのサブタイプである可能性を示唆するものである。  Fig.41;p110 Fig.41;p110 /p85-PI3-キナーゼ 2;G /p85-PI3-キナーゼ 2;G  -感受性PI3-キナーゼ A;各抗体の認識部位 B;46-kDa活性調節サブユニットの性状ii)G -感受性PI3-キナーゼ A;各抗体の認識部位 B;46-kDa活性調節サブユニットの性状ii)G  とチロシンリン酸化ペプチドによる相乗的な活性化 とチロシンリン酸化ペプチドによる相乗的な活性化 G  感受性PI3-キナーゼを構成するp46はSH2ドメインを含むと考えられたので、SH2ドメインと結合するチロシンリン酸化ペプチドが、p110 感受性PI3-キナーゼを構成するp46はSH2ドメインを含むと考えられたので、SH2ドメインと結合するチロシンリン酸化ペプチドが、p110 /p46のキナーゼ活性に与える影響を検討した。Fig.4Aに示すように、このペプチド単独では、p110 /p46のキナーゼ活性に与える影響を検討した。Fig.4Aに示すように、このペプチド単独では、p110 /p46の活性はわずかに上昇する程度であった。しかしながら、G /p46の活性はわずかに上昇する程度であった。しかしながら、G  存在下にこのペプチドを添加すると、キナーゼ活性は著しくかつ相乗的に活性化された。また、このG 存在下にこのペプチドを添加すると、キナーゼ活性は著しくかつ相乗的に活性化された。また、このG  による活性化はGDP結合型G による活性化はGDP結合型G を添加しエフェクター分子に対して活性型である遊離G を添加しエフェクター分子に対して活性型である遊離G  を不活性型に戻すことにより抑制された(Fig.5B)。なお、リン酸化チロシンを含まないコントロールペプチドでは、G を不活性型に戻すことにより抑制された(Fig.5B)。なお、リン酸化チロシンを含まないコントロールペプチドでは、G  存在下における相乗的な活性化は見られなかった。 存在下における相乗的な活性化は見られなかった。 以上の結果は、G  によるp110 によるp110 /p46の活性化の増強が、p46上に存在すると考えられるSH2ドメインとチロシンリン酸化ペプチドとの相互作用に依存して発現することを示唆している。 /p46の活性化の増強が、p46上に存在すると考えられるSH2ドメインとチロシンリン酸化ペプチドとの相互作用に依存して発現することを示唆している。 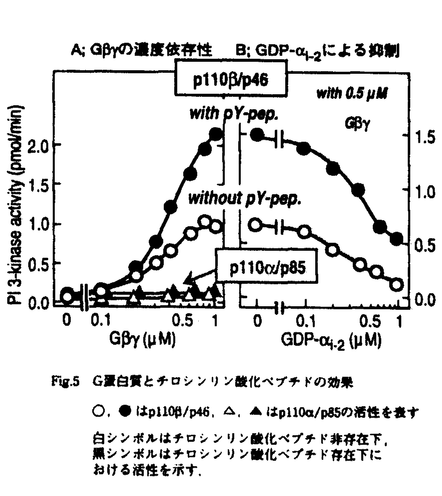 Fig.5 G蛋白質とチロシンリン酸化ペプチドの効果○,●はp110 Fig.5 G蛋白質とチロシンリン酸化ペプチドの効果○,●はp110 /p46,△,▲はp110 /p46,△,▲はp110 /p85の活性を表す 白シンボルはチロシンリン酸化ペプチド非存在下,黒シンボルはチロシンリン酸化ペプチド存在下における活性を示す.4.G /p85の活性を表す 白シンボルはチロシンリン酸化ペプチド非存在下,黒シンボルはチロシンリン酸化ペプチド存在下における活性を示す.4.G  感受性PI3-キナーゼとしてのp110 感受性PI3-キナーゼとしてのp110 /p85サブタイプ /p85サブタイプ ところで、先にも述べたがp110 はp85と結合することが知られている、そこでp110 はp85と結合することが知られている、そこでp110 /p85に関してもG /p85に関してもG  の効果が再現されるかを検討した.p110 の効果が再現されるかを検討した.p110 /p85-PI3-キナーゼは、ラット肝臓細胞質画分より別途精製し、その精製の最終段階であるMono Qカラムクロマトグラフィーにおいて、イムノブロットにより検出されるp110 /p85-PI3-キナーゼは、ラット肝臓細胞質画分より別途精製し、その精製の最終段階であるMono Qカラムクロマトグラフィーにおいて、イムノブロットにより検出されるp110 /p85とPI3-キナーゼ活性の溶出のパターンは完全に一致し、さらにp110 /p85とPI3-キナーゼ活性の溶出のパターンは完全に一致し、さらにp110 /p85溶出パターンに一致する形でG /p85溶出パターンに一致する形でG  およびG およびG  とチロシンリン酸化ペプチドによる相乗的な活性上昇が認められた。p85と複合体を形成する110-kDa触媒サブユニットには、 とチロシンリン酸化ペプチドによる相乗的な活性上昇が認められた。p85と複合体を形成する110-kDa触媒サブユニットには、 と と のサブタイプが存在することが知られているが、同じ組織より別途精製したp110 のサブタイプが存在することが知られているが、同じ組織より別途精製したp110 /p85は、チロシンリン酸ペプチドの有無にかかわらず、G /p85は、チロシンリン酸ペプチドの有無にかかわらず、G  によって活性化されなかった(Fig.5A)。このp110/p85サブタイプを用いた結果は、これまで調節サブユニットと結合することから同じであると考えられていたヘテロダイマー型PI3-キナーゼの制御機構がサブタイプにより異なり、p110 によって活性化されなかった(Fig.5A)。このp110/p85サブタイプを用いた結果は、これまで調節サブユニットと結合することから同じであると考えられていたヘテロダイマー型PI3-キナーゼの制御機構がサブタイプにより異なり、p110 は調節サブユニットのタイプに関わらず、G は調節サブユニットのタイプに関わらず、G  により活性化されることが明らかになった. により活性化されることが明らかになった.  Fig.6 Mono Qカラムクロマトグラフィーによるp110 Fig.6 Mono Qカラムクロマトグラフィーによるp110 /p85の分離A;Mono Qカラムクロマトグラフィーにより分離されたフラクションを抗PI3-キナーゼ抗体でイムノブロットした結果 上段;抗p110b抗体 下段;抗p85抗体 B;Mono Qカラムクロマトグラフィーにより分離されたPI3-キナーゼ活性の特性 ○;基礎活性 ●;500nMG /p85の分離A;Mono Qカラムクロマトグラフィーにより分離されたフラクションを抗PI3-キナーゼ抗体でイムノブロットした結果 上段;抗p110b抗体 下段;抗p85抗体 B;Mono Qカラムクロマトグラフィーにより分離されたPI3-キナーゼ活性の特性 ○;基礎活性 ●;500nMG   存在下 ▲;500nM G 存在下 ▲;500nM G  と230 Mtチロシンリン酸化ペプチド存在下の活性を表す.5.G と230 Mtチロシンリン酸化ペプチド存在下の活性を表す.5.G  感受性PI3-キナーゼ(p110 感受性PI3-キナーゼ(p110 /p46)が有する蛋白質キナーゼ活性 /p46)が有する蛋白質キナーゼ活性 これまで単離されているp110 を含むp110アイソザイムは脂質キナーゼドメイン以外に、蛋白質キナーゼサブドメインを持つことが知られている。実際にp110 を含むp110アイソザイムは脂質キナーゼドメイン以外に、蛋白質キナーゼサブドメインを持つことが知られている。実際にp110 はMnCl2存在下において蛋白質キナーゼ活性を示し、その調節サブユニットを自己リン酸化する。そこでG はMnCl2存在下において蛋白質キナーゼ活性を示し、その調節サブユニットを自己リン酸化する。そこでG  感受性PI3-キナーゼであるp110 感受性PI3-キナーゼであるp110 /p46が蛋白質キナーゼ活性を持つ可能性に関して検討を行った。結果は、このPI3-キナーゼはMnCl2存在下においてのみ、両サブユニットを自己リン酸化した(Fig.7A).またATP存在下、非存在化においてin vitroキナーゼ反応を行う事により、自己リン酸化された標品中でこの酵素の特徴であるG /p46が蛋白質キナーゼ活性を持つ可能性に関して検討を行った。結果は、このPI3-キナーゼはMnCl2存在下においてのみ、両サブユニットを自己リン酸化した(Fig.7A).またATP存在下、非存在化においてin vitroキナーゼ反応を行う事により、自己リン酸化された標品中でこの酵素の特徴であるG  による活性化が抑制された(Fig.7B)。なお、この自己リン酸化によりこの酵素の基礎活性が抑制されることはなかった。 による活性化が抑制された(Fig.7B)。なお、この自己リン酸化によりこの酵素の基礎活性が抑制されることはなかった。  Fig.7A;G Fig.7A;G  感受性PI3-キナーゼ(p110 感受性PI3-キナーゼ(p110 /p46)の自己リン酸化 G /p46)の自己リン酸化 G  感受性PI3-キナーゼ(p110 感受性PI3-キナーゼ(p110 /p46)を用いてin vitroキナーゼ反応を行った後,抗p110 /p46)を用いてin vitroキナーゼ反応を行った後,抗p110 抗体で免疫沈降した標品をSDS-PAGEにより分離 B;自己リン酸化による脂質キナーゼ活性の抑制 G 抗体で免疫沈降した標品をSDS-PAGEにより分離 B;自己リン酸化による脂質キナーゼ活性の抑制 G  感受性PI3-キナーゼ標品をATP存在下,非存在下においてin vitroキナーゼ反応を行った後、抗p110 感受性PI3-キナーゼ標品をATP存在下,非存在下においてin vitroキナーゼ反応を行った後、抗p110 抗体による免疫沈降沈降物中のPI3-キナーゼ活性に対するG 抗体による免疫沈降沈降物中のPI3-キナーゼ活性に対するG (0.5M)とチロシンリン酸化ペプチド(230 M)の効果を測定した.まとめ (0.5M)とチロシンリン酸化ペプチド(230 M)の効果を測定した.まとめ 本研究により、これまで同じ考えられてきたp110 とp110 とp110 の制御機構に違いがあることが明らかになり、p110 の制御機構に違いがあることが明らかになり、p110 を触媒サブユニットにもつヘテロダイマー型PI3-キナーゼが、その活性調節サブユニットの種々にかかわらず、G蛋白質の を触媒サブユニットにもつヘテロダイマー型PI3-キナーゼが、その活性調節サブユニットの種々にかかわらず、G蛋白質の  サブユニットによって活性化されることが明らかになった。さらに、活性調節サブユニットに含まれるSH2ドメインとリン酸化チロシンとの相互作用により、G サブユニットによって活性化されることが明らかになった。さらに、活性調節サブユニットに含まれるSH2ドメインとリン酸化チロシンとの相互作用により、G  による活性化が増強されるという知見は、p110 による活性化が増強されるという知見は、p110 を触媒サブユニットにもつヘテロダイマー型PI3-キナーゼが、G蛋白質とチロシンキナーゼという2種のシグナル伝達経路のクロストーク部位としての役割果たすという新しい制御機構の存在を示唆するものである。また、46-kDaの調節サブユニットに関しては新規であることが期待されたが、その実体を示すことはできなかった。しかしながら、最近になって相次いで単離された55-kDaの調節サブユニットとその構造的特徴が似ていることから、おそらくこのサブタイプの1つであると考えられる。このタイプのPI3-キナーゼの制御機構は現時点では全く不明である。しかしながら、これまでに知られているPI3-キナーゼが蛋白質間相互作用によって活性化されること、また、この55-kDaの調節サブユニットのN末部には、このタイプにのみ保存されている34アミノ酸からなる配列を含んでいることから、この配列を介して独自の情報伝達経路上において機能していると考えられ、今後の研究が期待されるところである。 を触媒サブユニットにもつヘテロダイマー型PI3-キナーゼが、G蛋白質とチロシンキナーゼという2種のシグナル伝達経路のクロストーク部位としての役割果たすという新しい制御機構の存在を示唆するものである。また、46-kDaの調節サブユニットに関しては新規であることが期待されたが、その実体を示すことはできなかった。しかしながら、最近になって相次いで単離された55-kDaの調節サブユニットとその構造的特徴が似ていることから、おそらくこのサブタイプの1つであると考えられる。このタイプのPI3-キナーゼの制御機構は現時点では全く不明である。しかしながら、これまでに知られているPI3-キナーゼが蛋白質間相互作用によって活性化されること、また、この55-kDaの調節サブユニットのN末部には、このタイプにのみ保存されている34アミノ酸からなる配列を含んでいることから、この配列を介して独自の情報伝達経路上において機能していると考えられ、今後の研究が期待されるところである。 さらに、p110 /p46は脂質キナーゼ活性以外に、蛋白質キナーゼ活性を有し、両サブユニットを自己リン酸化することを示した。さらに、自己リン酸化がG /p46は脂質キナーゼ活性以外に、蛋白質キナーゼ活性を有し、両サブユニットを自己リン酸化することを示した。さらに、自己リン酸化がG  によるこの酵素の活性化を抑制するという結果は、PI3-キナーゼの活性が、G によるこの酵素の活性化を抑制するという結果は、PI3-キナーゼの活性が、G  やSH2ドメインなどの蛋白質相互作用以外に、化学修飾によっても制御されうる可能性を示唆するものである。 やSH2ドメインなどの蛋白質相互作用以外に、化学修飾によっても制御されうる可能性を示唆するものである。 これまでの知見より、PI3-キナーゼが細胞内情報伝達経路の起点となる分子であることは周知の事実である。今後、本論文に示したこのキナーゼが持つユニークな活性制御機構、およびユニークな酵素活性の特性をさらに解明する中でこの分子の真の生理的意義が明らかにされるものと考える。 |