アポトーシスは、核の崩壊、DNAの規則的な断片化を伴う細胞自身の機能による積極的な死の形態である。Fas ligandやTNF- は標的細胞表面のそれぞれの受容体に結合することによって細胞死のシグナルを伝達し、アポトーシスを誘導する。一方、多くの抗癌剤は核のDNAに傷害を与えることにより細胞にアポトーシスを誘導すると考えられるが、そのメカニズムはよく分かっていない。アポトーシスのメカニズムを解析するために、本研究室では、ヒト単芽球系白血病細胞U937を用い、VP-16など抗癌剤によるアポトーシス誘導に特異的に抵抗性を示す変異株UK711、FasやTNFによるアポトーシス誘導に特異的に抵抗性を示す変異株UK110を樹立し、その性状解析を行なってきた。今回、私は、Fas、TNF、抗癌剤に抵抗性の変異株UC細胞を樹立し、その解析からアポトーシス誘導機構に関わる分子を検索した。 は標的細胞表面のそれぞれの受容体に結合することによって細胞死のシグナルを伝達し、アポトーシスを誘導する。一方、多くの抗癌剤は核のDNAに傷害を与えることにより細胞にアポトーシスを誘導すると考えられるが、そのメカニズムはよく分かっていない。アポトーシスのメカニズムを解析するために、本研究室では、ヒト単芽球系白血病細胞U937を用い、VP-16など抗癌剤によるアポトーシス誘導に特異的に抵抗性を示す変異株UK711、FasやTNFによるアポトーシス誘導に特異的に抵抗性を示す変異株UK110を樹立し、その性状解析を行なってきた。今回、私は、Fas、TNF、抗癌剤に抵抗性の変異株UC細胞を樹立し、その解析からアポトーシス誘導機構に関わる分子を検索した。  Fig.1 Flow cytometric analysis of development of apoptosis in U937 and UC after treatment with TNF(0.3ng/ml)/CHX(1 Fig.1 Flow cytometric analysis of development of apoptosis in U937 and UC after treatment with TNF(0.3ng/ml)/CHX(1 g/ml) for 4h,and VP-16(10 g/ml) for 4h,and VP-16(10 g/ml) for 4h g/ml) for 4h ヒト単芽球性白血病細胞U937は各種抗癌剤、TNF- 、抗Fas抗体等によりアポトーシスを起こすことが知られている。まずU937細胞を変異誘発剤処理した後、TNF- 、抗Fas抗体等によりアポトーシスを起こすことが知られている。まずU937細胞を変異誘発剤処理した後、TNF- によって誘導されるアポトーシスに耐性を示す種々のU937変異株を単離した。これらの中で変異株UC細胞は、TNF- によって誘導されるアポトーシスに耐性を示す種々のU937変異株を単離した。これらの中で変異株UC細胞は、TNF- のみでなく、Fas、抗癌剤VP-16によるアポトーシスにも耐性を示した(Fig.1)。UCはTNF受容体、Fas抗原を親株のU937と同程度発現しているため、受容体にdeath ligandが結合した後の情報伝達機構に変異があることが予想された。また、UCは、VP-16以外にAra-C、ADM、CDDP等の薬剤によるアポトーシスにも耐性を示した。UCは、変異原処理して得られた細胞株であり、継代培養に選択薬剤が不要で、かつアポトーシス耐性の形質が安定なことから、genctic mutationがあると考えられた。そこで、アポトーシス関連分子の発現を検討したところ、UC細胞においては親株U937細胞と比べ、c-Mycの発現の顕著な低下が認められた(Fig.2)。一方、アポトーシス抑制因子Bcl-2の発現は親株と同等であった。 のみでなく、Fas、抗癌剤VP-16によるアポトーシスにも耐性を示した(Fig.1)。UCはTNF受容体、Fas抗原を親株のU937と同程度発現しているため、受容体にdeath ligandが結合した後の情報伝達機構に変異があることが予想された。また、UCは、VP-16以外にAra-C、ADM、CDDP等の薬剤によるアポトーシスにも耐性を示した。UCは、変異原処理して得られた細胞株であり、継代培養に選択薬剤が不要で、かつアポトーシス耐性の形質が安定なことから、genctic mutationがあると考えられた。そこで、アポトーシス関連分子の発現を検討したところ、UC細胞においては親株U937細胞と比べ、c-Mycの発現の顕著な低下が認められた(Fig.2)。一方、アポトーシス抑制因子Bcl-2の発現は親株と同等であった。  Fig.2 Immunoblot analysis of c-Myc in U937(lane1),UC(lane2),UC/mock(lane3),cloneI-10(lane4)and clone III-4(lane5) Fig.2 Immunoblot analysis of c-Myc in U937(lane1),UC(lane2),UC/mock(lane3),cloneI-10(lane4)and clone III-4(lane5)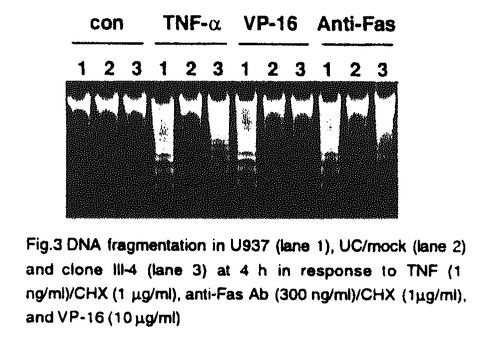 Fig.3 DNA fragmentation in U937(lane1),UC/mock(lane2) and clone III-4(lane3) at 4 h in response to TNF(1ng/ml)/CHX(1 Fig.3 DNA fragmentation in U937(lane1),UC/mock(lane2) and clone III-4(lane3) at 4 h in response to TNF(1ng/ml)/CHX(1 g/ml),anti-Fas Ab (300ng/ml)/CHX(1 g/ml),anti-Fas Ab (300ng/ml)/CHX(1 g/ml),and VP-16(10 g/ml),and VP-16(10 g/ml) g/ml) Fig.4 Sensitivity of U937 cells against TNF or VP-16 for 24h,after 48 h pretreatment with HEPES,50 Fig.4 Sensitivity of U937 cells against TNF or VP-16 for 24h,after 48 h pretreatment with HEPES,50 M c-myc sense(SON)and 50 M c-myc sense(SON)and 50 M c-myc antisense (ASON) M c-myc antisense (ASON) c-Mycは、T細胞のactivation-induced cell deathに関与することが知られているが、抗癌剤によるアポトーシスに関与するかどうかは明らかではない。UC細胞で、c-Mycが減少していることから、c-MycがTNF,Fas,VP-16によるアポトーシス誘導に関与するのではないかと考えられた。そこで、UC細胞にc-myc遺伝子を導入しTNFやVP-16によるアポトーシス感受性が回復されるかどうかを検討した。その結果、c-mycタンパクの発現量がU937と同程度にまで増えたcloneIII-4では、TNF,FasによるアポトーシスにU937と同程度の感受性を示した(Fig.2,3)。また、これに伴って、アポトーシスに重要な機能を果たすCPP32の活性化も、UCでは抑制されていたが、cloneIII-4ではU937と同様に認められた。これらの結果から、導入したc-myc遺伝子は、TNF刺激後のCPP32活性化のシグナル伝達に関与することが確認された。 一方、UCにおけるVP-16誘導アポトーシスに対する抵抗性はc-myc導入によっても回復されなかった(Fig.3)。この結果から、(1)VP-16によるアポトーシス誘導にc-mycは関与しない可能性と、(2)VP-16によるアポトーシス誘導にc-mycは関与するが、UC細胞にはさらに別の変異があるため、c-mycを導入しても、VP-16によるアポトーシス耐性は回復できない可能性が考えられた。  Fig.5 Sensitivity of U937 X UC hybrid cells against TNF(0.03ng/ml)/CHX(1 Fig.5 Sensitivity of U937 X UC hybrid cells against TNF(0.03ng/ml)/CHX(1 g/ml) or VP-16(0.3 g/ml) or VP-16(0.3 g/ml) g/ml) c-Mycの低下したUC細胞では、c-myc遺伝子の導入によりTNF,Fasによるアポトーシス誘導能が回復したのに対し、VP-16によるアポトーシス誘導は回復されなかった。そこで、c-MycがVP-16によるアポトーシスに関係するかどうかを調べるため、c-myc antisense処理によってU937細胞内のc-Myc発現量を低下させ、アポトーシス感受性の変化を検討した。その結果、c-myc antisense処理によって、U937細胞は、TNF、VP-16によるアポトーシス誘導にともに耐性となることが明らかになった。さらに、TNF- 、抗癌剤VP-16に対する感受性を細胞生存率で比較したところ、c-myc antisense処理により、TNF、VP-16に対して耐性を示した(Fig.4)。以上の結果から、TNF,Fasだけでなく、VP-16によるアポトーシス誘導においてもc-Mycが関与するものと考えられた。 、抗癌剤VP-16に対する感受性を細胞生存率で比較したところ、c-myc antisense処理により、TNF、VP-16に対して耐性を示した(Fig.4)。以上の結果から、TNF,Fasだけでなく、VP-16によるアポトーシス誘導においてもc-Mycが関与するものと考えられた。 今までの実験結果より、UCのVP-16によるアポトーシス誘導に対する耐性には、c-myc以外のgeneticmutationがあると考えられた。この点をさらに検討するために、U937とUCにそれぞれNeo,Bsr遺伝子を導入し、ポリエチレングリコール法で細胞融合を行ない、融合細胞におけるTNF、VP-16の感受性を検討した。その結果、融合細胞がTNFに感受性であることが認められ、UCの耐性形質が遺伝学的に劣性であることが示された(Fig.5)。これはUCにおけるc-Mycの低下がTNF耐性の原因となっていることを支持する結果と考えられた。 一方、この融合細胞はVP-16に対し、UCと同様に耐性を示した。この結果から、UC細胞の抗癌剤耐性形質が細胞遺伝学的に優性であること、すなわち、c-Mycの変化以外に別の優性な変異が、UC細胞における抗癌剤VP-16に対する耐性形質に関与する可能性が示唆された。 本研究に於て、私はTNF,Fas,抗癌剤VP-16によるアポトーシスに耐性な変異株UC細胞を樹立した。UCではc-Mycの低下が見られ、c-myc導入により、TNF、FasによるICE-like protease活性化、およびアポトーシス誘導が回復した。他方VP-16によるアポトーシス誘導はUCにc-mycを導入することによっても回復されなかったが、c-myc antisenseの結果から、VP-16によるアポトーシス誘導におけるc-myc遺伝子の関与が明らかになった。さらに細胞融合実験とc-myc遺伝子導入実験により、変異株UCがc-Myc発現低下以外に、抗癌剤VP-16によるアポトーシス誘導に関与する別の優性変異をもっている可能性が考えられた。 c-mycタンパクが、どのような機能で、ICEファミリープロテアーゼ活性化に関与するのか、また、UC細胞のVP-16耐性に関与する変異については今後の課題である。 |