【結果】1)PAF-AH(II)の酸化リン脂質に対する分解作用 PAF-AH(II)は、リン脂質のグリセロール骨格2位に対する基質選択性がPAFのアセチル基のみでなく、プロピオニル基やブチロイル基のような短鎖脂肪酸鎖やサクシノイル基やグルタロイル基のような短鎖ジカルボン酸鎖に対しても分解活性を持つことが分かっていた。これらは生体内で高度不飽和脂肪酸が酸化開裂した時に生じ得るとされていることから、本酵素が生体内で生じた酸化リン脂質の分解・消去に関与している可能性が考えられた。そこで実際に、化学的に酸化したホスファチジルコリンを基質とし、その分解活性を測定した。その結果、PAF-AH(II)は2位に長鎖脂肪酸を持つホスファチジルコリンそのものには全く活性を示さなかったものの、酸化ホスファチジルコリンに対しては高い分解活性を示した(Fig.2)。
 【Fig.1】PAF Acetylhydrolases in Mammals
【Fig.1】PAF Acetylhydrolases in Mammals 【Fig.2】Preferential Hydrolysis of Oxidized Phospholipids by PAF-AH(II)2)PAF-AH(II)の細胞内局在性とミリスチル化
【Fig.2】Preferential Hydrolysis of Oxidized Phospholipids by PAF-AH(II)2)PAF-AH(II)の細胞内局在性とミリスチル化 酸化リン脂質は生体内で様々な酸素ストレスにより細胞膜中に生じるものと考えられる。そこで、酸化リン脂質を基質とするPAF-AH(II)も細胞内において細胞膜にも存在するか否か検討を加えた。まず本酵素の検出のために、PAF-AH(II)に対するモノクローナル抗体の作製を行った。方法は、ウシ肝臓可溶性画分より精製したPAF-AH(II)をBalb/cマウスに脾内免疫し、抗PAF-AH(II)抗体産生ハイブリドーマ(7F7)を選択樹立した。次にPAF-AH(II)を発現しているウシ腎臓上皮細胞由来のMDBK細胞を細胞質画分と膜画分とに分画し、本抗体によるイムノブロット解析を行った。その結果、PAF-AH(II)は細胞質のみならず膜画分にも半分程度存在していることが明らかとなった(Fig.3)。更に同抗体にてMDBK細胞の免疫蛍光染色を行ったところ、小胞体膜、特に核に近い小胞体が強く染色された(Fig.4)。この事実は、アラキドン酸等の不飽和脂肪酸代謝系の酵素群が核周辺膜で機能しているという最近の知見と合致していて興味深い。
遺伝子クローニングの結果、ウシ及びヒト共にPAF-AH(II)のN末端はGVNQS...となっており、この配列はGXXXS...というミリスチン酸結合モチーフに一致していた。そこで本酵素に実際、ミリスチン酸が結合しているか検討した。MDBK細胞の培地中に、放射標識ミリスチン酸を加え培養した後、細胞ライゼートを抗PAF-AH(II)モノクローナル抗体による免疫沈降を行い、本酵素にラベルが取り込まれるか否か調べた。その結果、PAF-AH(II)は確かにミリスチル化されていることが明らかとなった(Fig.5)。脂肪酸修飾蛋白質は一般に細胞膜への結合能を有している場合が多い。特にミリスチル化の場合、膜への親和性が高くなく、膜との結合に可逆性を持つと言われている。本酵素もこれと一致し、細胞質と膜の双方に局在していた。
 【Fig.3】Detection of PAF-AH(II)in Cytosol and Membranes of MDBK Cells
【Fig.3】Detection of PAF-AH(II)in Cytosol and Membranes of MDBK Cells  【Fig.4】Immunofluorostaining of MDBK Cells with Anti-PAF-AH(II)Antibody
【Fig.4】Immunofluorostaining of MDBK Cells with Anti-PAF-AH(II)Antibody 【Fig.5】Myristylation of PAF-AH(II)in MDBK Cells
【Fig.5】Myristylation of PAF-AH(II)in MDBK Cells 【Fig.6】Translocation of PAF-AH(II)from Cytosol to Membranes on Oxidative Stress in MDBK Cells3)酸素ストレスによるPAF-AH(II)の膜への移行
【Fig.6】Translocation of PAF-AH(II)from Cytosol to Membranes on Oxidative Stress in MDBK Cells3)酸素ストレスによるPAF-AH(II)の膜への移行 PAF-AH(II)が細胞内の膜画分にも局在し、そこで生じた過酸化脂質の分解・消去に関与しているとすると、酸素ストレス時のPAF-AH(II)の細胞内局在性に変化があるか否か興味が持たれた。
そこでMDBK細胞に過酸化水素やt-butylhydroperoxide(t-BuOOH)などの種々の酸素ストレスを与えて、PAF-AH(II)の細胞質と膜画分への分布の変化を調べた。すると、特にt-BuOOHで細胞を処理した場合に、その濃度依存的に本酵素は細胞質から膜画分へと移行することが明らかとなった(Fig.6)。この膜移行は、t-BuOOH処理後5〜20分という比較的短時間で起こることが分かった。過酸化水素の場合、単独では高濃度でのみ膜移行が観察されたが、過酸化水素の細胞内消去酵素であるカタラーゼに対する阻害剤aminotriazoleで予め細胞を処理することにより、低濃度でも膜移行が観察できた。酸素ストレス以外の様々な刺激では本酵素の膜移行は観察されず、この膜移行は酸素ストレス特異的な細胞応答であることが分かった。このとき、MDBK細胞の免疫蛍光染色像は、核近傍の小胞体のみでなく細胞全体の小胞体に、PAF-AH(II)の局在範囲が拡大することが観察された。
一方、逆に抗酸化剤propyl gallateによりMDBK細胞を処理したところ、その濃度依存的に、膜画分に存在していたPAF-AH(II)の細胞質への移行が観察された。これらの結果から、PAF-AH(II)が細胞内の酸素ストレスに応じて、その細胞内での局在性を変えていることが分かった。
 【Fig.7】 Protection against t-BuOOH Toxicity by PAF-AH(II) Overexpression
【Fig.7】 Protection against t-BuOOH Toxicity by PAF-AH(II) Overexpression  【Fig.8】DNA Ladder Formation of CHO-K1 Transformants Treated with t-BuOOH4) PAF-AH(II)過剰発現細胞の酸素ストレスに対する耐性
【Fig.8】DNA Ladder Formation of CHO-K1 Transformants Treated with t-BuOOH4) PAF-AH(II)過剰発現細胞の酸素ストレスに対する耐性 PAF-AH(II)が酸素ストレス時に膜へ移行し、酸化リン脂質を分解・消去しているとすると、その過剰発現細胞は酸素ストレスの細胞障害性に対して耐性を示すことが予想される。そこで、CHO-K1細胞にリポフェクチン法によりPAF-AH(II)cDNAをトランスフェクションし、選択樹立したPAF-AH(II)高発現株を用いて、酸素ストレスに対する耐性について検討を加えた。細胞を各濃度のt-BuOOHで3時間処理し、24時間後の生存率をMTT assay法にて評価した。その結果、PAF-AH(II)過剰発現細胞はコントロール細胞に対して生存率が有意に上昇することが明らかとなった(Fig.7)。この効果は、PAF-AH(II)の活性部位のSerをCysに置換して活性を潰したS236C mutantを過剰発現した場合には見られないことから(Fig.7)、耐性発現にはPAF-AH(II)の活性が必須であることが示された。このように、PAF-AH(II)が酸素ストレスによる細胞障害に対して防御的に働くことが示唆された。
5)PAF-AH(II)のアポトーシスに対する抑制効果 更に、300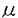 M t-BuOOH処理後の各CHO-K1トランスフォーマントの生存率を経時的に追ってみたところ、PAF-AH(II)過剰発現細胞には全く変化は見られなかったが、コントロール細胞及びS236C mutantを過剰発現した細胞は6〜8時間で急激な細胞死が起こることが分かった。そこで、これら各CHO-K1トランスフォーマントから抽出したDNAを電気泳動してみたところ、コントロール細胞及びS236C mutantを過剰発現した細胞にアポトーシスに特徴的なDNAラダーフォーメーションが観察された(Fig.8)。一方、PAF-AH(II)過剰発現細胞には、このDNAラダーフォーメーションは全く見られないことから(Fig.8)、PAF-AH(II)は酸素ストレスによるアポトーシスに対して抑制的に働くことが明らかとなった。この結果は、PAF-AH(II)がアポトーシスによる細胞死誘導メカニズムにも抑制系因子として寄与している可能性を示唆し、その細胞内情報伝達系での位置付けに興味が持たれた。
M t-BuOOH処理後の各CHO-K1トランスフォーマントの生存率を経時的に追ってみたところ、PAF-AH(II)過剰発現細胞には全く変化は見られなかったが、コントロール細胞及びS236C mutantを過剰発現した細胞は6〜8時間で急激な細胞死が起こることが分かった。そこで、これら各CHO-K1トランスフォーマントから抽出したDNAを電気泳動してみたところ、コントロール細胞及びS236C mutantを過剰発現した細胞にアポトーシスに特徴的なDNAラダーフォーメーションが観察された(Fig.8)。一方、PAF-AH(II)過剰発現細胞には、このDNAラダーフォーメーションは全く見られないことから(Fig.8)、PAF-AH(II)は酸素ストレスによるアポトーシスに対して抑制的に働くことが明らかとなった。この結果は、PAF-AH(II)がアポトーシスによる細胞死誘導メカニズムにも抑制系因子として寄与している可能性を示唆し、その細胞内情報伝達系での位置付けに興味が持たれた。