本研究は、脂肪細胞に特異的な遺伝子の発現を誘導するヘリックスループヘリックスロイシンジッパー型転写因子として同定されたADD1の発現と骨形成細胞である骨芽細胞の分化との関わりを明らかにするため、培養骨芽細胞におけるにおけるADD1遺伝子(mRNA)の発現、DNA結合能、転写活性とそのレチノイン酸による調節の解析を試みたものであり、下記の結果を得ている。 1.マウス由来の骨芽細胞様細胞であるMC3T3-E1細胞では、培養期間が長くなり細胞の密度が上昇するに従って、ADD1遺伝子の発現が増加することがNorthern blotにより示された.MC3T3-E1細胞はその培養期間が長くなるにつれアルカリフォスファターゼの発現が増加するなど骨芽細胞としての分化が促進されることが知られており、骨芽細胞の分化とADD1の発現との関連が示唆された。 2.骨芽細胞様細胞として分化度が高いとされているROS17/2.8細胞におけるADD1遺伝子の恒常的発現をNorthern blotにより認めた。カルシウム向性の調節因子のうち、レチノイン酸でROS17/2.8細胞を処理することによりADD1遺伝子の発現が促進された。このレチノイン酸によるADD1遺伝子の発現促進は処理時間および濃度に依存し、それぞれ8時間と10-6Mでレチノイン酸の効果が最大となった。レチノイン酸によるADD1遺伝子の発現促進は、蛋白合成阻害剤であるサイクロヘキシミドにより阻害されず、転写阻害剤であるDRBにより阻害された。また、転写阻害剤であるアクチノマイシンDの存在下ではレチノイン酸の存在の有無に関わらず時間経過とともにADD1遺伝子の発現は減少した。これらにより、ROS17/2.8細胞におけるレチノイン酸によるADD1遺伝子の発現促進は蛋白の生合成や転写産物の安定化を介さない転写の促進によると考えられた。 3.ROS 17/2.8細胞におけるレチノイン酸によるADD1遺伝子の発現促進は、他のステロイド受容体のリガンドであるビタミンD3、デキサメサゾン、エストラジオールの存在により影響されないことがNorthern blotにより示された。 4.ADD1を認識するDNA塩基配列を含むオリゴヌクレオチドをプローブとしてゲルシフトアッセイを行ったところ、ROS17/2.8細胞から調製した核抽出画分中に、塩基配列に変異を導入したオリゴヌクレオチドでは阻害されない、塩基配列特異的なDNA結合能が認められた。レチノイン酸処理によるこのDNA結合能の促進が認められ、蛋白レベルでもレチノイン酸によるADD1の発現促進が示された。また、このDNA結合能に対して、E2A蛋白のホモ二量体を認識するDNA配列(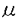 E5十 E5十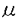 E2)やMyo-D/E2A蛋白のヘテロ二量体(MEF1)を認識するDNA塩基配列を含むオリゴヌクレオチドによる競合阻害は認められなかった。したがって、認められたDNA-蛋白結合は、E2A蛋白のホモ二量体やMyo-DとE2A蛋白とのヘテロ二量体によるものではないと考えられた。 E2)やMyo-D/E2A蛋白のヘテロ二量体(MEF1)を認識するDNA塩基配列を含むオリゴヌクレオチドによる競合阻害は認められなかった。したがって、認められたDNA-蛋白結合は、E2A蛋白のホモ二量体やMyo-DとE2A蛋白とのヘテロ二量体によるものではないと考えられた。 5.ADD1の結合配列に連結したCAT遺伝子をROS17/2.8細胞に導入したところ、レチノイン酸によるCATの発現促進が認められた。したがって、レチノイン酸はADD1蛋白の持つ転写活性能も促進すると考えられた。 5.ROS17/2.8細胞のみならず他の骨芽細胞様細胞株であるRCT-1細胞や、ラット頭蓋冠由来の初代培養細胞においてもレチノイン酸によるADD1遺伝子の発現促進がNorthern blotにより認められ、この現象はROS17/2.8細胞のみに特有ではなく、複数の骨芽細胞モデルで観察されることが示された。 6.ROS17/2.8細胞にADD1発現ベクターを導入して樹立した永久変異細胞株ではADD1発現ベクターの親ベクターを導入して樹立した細胞株に比べ、オステオカルシン遺伝子の発現量が増加していることがNorthern blotにより示された。したがって、ADD1は骨芽細胞の分化に対して正に制御を行うと考えられた。 以上、本論文は骨芽細胞におけるADD1の発現とそのレチノイン酸による調節を明かにした。本研究はこれまで報告されていない、骨芽細胞の分化に正の制御を行う転写因子の存在を明かにしており、骨形成の分子機構の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |