本論文は、2章からなり、第1章は、インターフェロン(IFN)- 遺伝子欠損(KO)マウスの作製、第2章は、コンカナバリンA(ConA)誘導肝炎の発症機構について述べられている。 遺伝子欠損(KO)マウスの作製、第2章は、コンカナバリンA(ConA)誘導肝炎の発症機構について述べられている。 本研究では、感染・炎症におけるIFN- の役割を解析することを目的として、IFN- の役割を解析することを目的として、IFN- KOマウスを作製している。KOマウスは、マウス染色体上のIFN- KOマウスを作製している。KOマウスは、マウス染色体上のIFN- 遺伝子の第1エクソン中の翻訳開始コドンに、大腸菌のlacZ遺伝子とネオマイシン耐性遺伝子(neo)を挿入して作製した。IFN- 遺伝子の第1エクソン中の翻訳開始コドンに、大腸菌のlacZ遺伝子とネオマイシン耐性遺伝子(neo)を挿入して作製した。IFN- KOマウスは他のグループによっても作製されているが、本研究により作製されたIFN- KOマウスは他のグループによっても作製されているが、本研究により作製されたIFN- KOマウスは、単に遺伝子を欠損させれているだけでなく、IFN- KOマウスは、単に遺伝子を欠損させれているだけでなく、IFN- の産生細胞がlacZ遺伝子の発現によって検出できる点が優れている。 の産生細胞がlacZ遺伝子の発現によって検出できる点が優れている。 次に、作製されたIFN- KOマウスを用いて、申請者は肝炎における本サイトカインの役割を解析している。本研究で用いられたConA誘導肝炎は、ヒトのウイルス性肝炎や細菌、薬物による肝炎のモデルとされるもので、ConAがT細胞に作用した結果産生されてくるIFN- KOマウスを用いて、申請者は肝炎における本サイトカインの役割を解析している。本研究で用いられたConA誘導肝炎は、ヒトのウイルス性肝炎や細菌、薬物による肝炎のモデルとされるもので、ConAがT細胞に作用した結果産生されてくるIFN- やTNF- やTNF- 、IL-1などのサイトカインが、発症に重要な役割を果たしているのではないかと考えられている。 、IL-1などのサイトカインが、発症に重要な役割を果たしているのではないかと考えられている。 IFN- KOマウスにConAを投与したところ、コントロールマウスに比べて有意に低感受性になっていることが示された。このとき、野生型マウスでは肝実質細胞にアポトーシスが認められるのに対し、IFN- KOマウスにConAを投与したところ、コントロールマウスに比べて有意に低感受性になっていることが示された。このとき、野生型マウスでは肝実質細胞にアポトーシスが認められるのに対し、IFN- KOマウスでは起こっていなかった。この結果、ConAにより誘導されたIFN- KOマウスでは起こっていなかった。この結果、ConAにより誘導されたIFN- が肝細胞のアポトーシスを引き起こし、肝炎を発症させていることが初めて示された。 が肝細胞のアポトーシスを引き起こし、肝炎を発症させていることが初めて示された。 ところで、抗TNF抗体によってConA肝炎の発症が抑制されるという報告が既にあることから、申請者は、TNF- の役割についても検討している。TNF- の役割についても検討している。TNF- KOマウスを用いて同じように発症を検討したところ、TNF- KOマウスを用いて同じように発症を検討したところ、TNF- KOマウスでもConAに対する感受性は変わらないことがわかった。IL-1についても、IL-1 KOマウスでもConAに対する感受性は変わらないことがわかった。IL-1についても、IL-1 / /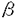 のダブルKOマウスを用いて発症を検討したが、感受性に差を認めなかった。従って、これらのサイトカインはConA肝炎の発症には関与していないと考えられる。抗体を用いた以前の解析は、交叉反応の結果である可能性が示唆された。 のダブルKOマウスを用いて発症を検討したが、感受性に差を認めなかった。従って、これらのサイトカインはConA肝炎の発症には関与していないと考えられる。抗体を用いた以前の解析は、交叉反応の結果である可能性が示唆された。 さらに別の報告で、肝実質細胞のアポトーシスに一酸化窒素が関与する可能性が示されていたため、申請者は誘導型一酸化窒素合成酵素(iNOS)の発現誘導を検討した。その結果、IFN- KOマウスの肝臓ではこの酵素の発現誘導が起こらないことがわかった。しかし、iNOSの特異的阻害剤をマウスに投与してもConA肝炎の発症に差は認められなかったことから、IFN- KOマウスの肝臓ではこの酵素の発現誘導が起こらないことがわかった。しかし、iNOSの特異的阻害剤をマウスに投与してもConA肝炎の発症に差は認められなかったことから、IFN- KOマウスで肝炎が発症しないのは、この酵素の誘導阻害によるものではないと結論している。KOマウスや酵素阻害剤を用いた解析から得られたこれらの結論は、従来のConA肝炎の発症機構に対する考え方を覆すものであり、ヒト肝炎の発症機構の解明に大きく貢献するものと評価できる。 KOマウスで肝炎が発症しないのは、この酵素の誘導阻害によるものではないと結論している。KOマウスや酵素阻害剤を用いた解析から得られたこれらの結論は、従来のConA肝炎の発症機構に対する考え方を覆すものであり、ヒト肝炎の発症機構の解明に大きく貢献するものと評価できる。 次に申請者は、アポトーシスのメカニズムについて検討を加えている。アポトーシスに関与することが知られているfas遺伝子の発現を調べたところ、IFN- KOマウスでは約1/2に低下していることがわかった。また、fas遺伝子に変異のあるIprマウスでは肝炎の発症が抑えられたことから、ConA肝炎にみられる肝細胞のアポトーシスには、IFN- KOマウスでは約1/2に低下していることがわかった。また、fas遺伝子に変異のあるIprマウスでは肝炎の発症が抑えられたことから、ConA肝炎にみられる肝細胞のアポトーシスには、IFN- によるFas-Fasリガンドシステムの活性化が関与していることを初めて明らかにした。しかし、IprマウスのConAに対する感受性はIFN- によるFas-Fasリガンドシステムの活性化が関与していることを初めて明らかにした。しかし、IprマウスのConAに対する感受性はIFN- KOマウスよりも高いことから、Fasを介した経路以外に、IFN- KOマウスよりも高いことから、Fasを介した経路以外に、IFN- による肝実質細胞の直接的なアポトーシスの誘導も考えられ、アポトーシスの分子機構の解明が今後の検討課題として残された。 による肝実質細胞の直接的なアポトーシスの誘導も考えられ、アポトーシスの分子機構の解明が今後の検討課題として残された。 本研究ではConA誘導肝炎において、IFN- が重要な役割を果たしていることを初めて明らかにしたが、ヒトのウイルス性肝炎や、アルコール性肝炎、敗血症などの場合もIFN- が重要な役割を果たしていることを初めて明らかにしたが、ヒトのウイルス性肝炎や、アルコール性肝炎、敗血症などの場合もIFN- の亢進が認められ、同様の機構が働いている可能性がある。また、IFNによるアポトーシス誘導能の発見は、ウイルス感染時に、感染細胞の周辺非感染細胞にアポトーシスを誘導することによって、感染の拡大を防いでいる可能性を提起するものであり、IFNの生理的・病理的役割について新しい示唆を与えるものである。 の亢進が認められ、同様の機構が働いている可能性がある。また、IFNによるアポトーシス誘導能の発見は、ウイルス感染時に、感染細胞の周辺非感染細胞にアポトーシスを誘導することによって、感染の拡大を防いでいる可能性を提起するものであり、IFNの生理的・病理的役割について新しい示唆を与えるものである。 なお、本論文第1章は、岩倉洋一郎博士(東京大学)、第2章は、岩倉洋一郎博士、関川賢二博士(家畜衛生試験場)と三田村圭二博士(昭和大学)との共同研究であるが、論文提出者が主体となってIFN- KOマウスの作製および肝炎の発症機構の解析を行ったもので、論文提出者の寄与が十分であると判断する。 KOマウスの作製および肝炎の発症機構の解析を行ったもので、論文提出者の寄与が十分であると判断する。 よって、博士(理学)の学位を授与できるものと認める。 |