生体の主要な構成成分である蛋白質は、生命が運営されていく上でたえず合成と分解をつづけており、変化の状態、あるいは、動的な平衡の状態におかれている。それゆえ、蛋白質の代謝は生命の営みそのものとさえ言えるほど重要である。この蛋白質代謝においてプロセッシングと、分解除去の過程を担っているのがプロテアーゼと呼ばれる酵素群である。プロテアーゼは主にセリンプロテアーゼ、システインプロテアーゼ、アスパラギン酸プロテアーゼ、メタロプロテアーゼの4つのグループに分類される。これまでのプロテアーゼの研究は生化学的な取り組みやすさから主に哺乳類と植物を用いておこなわれてきた。哺乳類を用いた研究により、セリンプロテアーゼとシステインプロテアーゼがそれぞれ細胞外と細胞内で重要な役割をしていることが示されたのはその大きな成果といえる。しかし近年、センチニクバエ(Sarcophagaperegrina)から見いだされたカテプシンLやカテプシンB(システインプロテアーゼに属する代表的な酵素)が分泌型酵素として発生過程に機能することが示され、システインプロテアーゼが細胞外でも機能することが提示された。この新たな発見に関しては、昆虫のプロテアーゼに着目したことの意義が大きい。 さらに、このセンチニクバエに着目することで、新たなシステインプロテアーゼとして、26・29kDaプロテアーゼが見いだされた。このプロテアーゼは既知のシステインプロテアーゼとは異なり、次のような2つの特徴を有していた。(1)26kDa及び29kDaの2つのサブユニットから構成されている。(2)幼虫体内への異物注入により体液細胞から体液中に分泌され、生体防御にはたらくと考えられる。このように、26・29kDaプロテアーゼが構造的にも機能的にも、これまでにない新しいプロテアーゼと考えられたので、このプロテアーゼを研究することで、プロテアーゼの新たな側面にせまりうることが期待された。そこで、今回私はこのプロテアーゼの解析の一環として、まずcDNAクローニングをおこない、その1次構造を明らかにした。次いで、このプロテアーゼの性状を知る目的で基質特異性について考察し、また、発現時期を調べた。さらに、このプロテアーゼが他の生物にも保存されているかどうかを知るために、ホモログの単離をおこなった。 (I)26・29kDaプロテアーゼは1つの前駆体蛋白のプロセッシングによってつくられる。 はじめに、26kDa、29kDaのそれぞれのサブユニットの部分アミノ酸配列を決定した。つぎに、26kDaサブユニットから得られたペプチドの配列をもとに26kDaサブユニットのcDNAを単離した。得られたcDNAの最長ORFにコードされた蛋白のアミノ酸配列は、26kDaサブユニット由来のペプチドの配列を全て含んでいたが、それだけではなく、後半部分に29kDaサブユニット由来のペプチドの配列も全て含んでいた。このことから、2つのサブユニットは最初は1つの前駆体蛋白としてつくられるものと考えられた。 ホモロジー検索の結果、26kDaサブユニットに対応する部分は既知の蛋白とは類似していなかった。29kDaサブユニットの部分はカテプシンLの成熟型酵素と高い類似性を示した。2つのサブユニットの中間の部分はカテプシンL型プロテアーゼの前駆体にみられるプロ配列に類似しており、26・29kDaプロテアーゼの前駆体はシステインプロテアーゼを前駆体型酵素として含んでいることがわかった(Fig.1)。  Fig.1 Alignment of 26・29kDa protease and cathepsin L Fig.1 Alignment of 26・29kDa protease and cathepsin L これらのことから26・29kDaプロテアーゼは、(1)はじめ、カテプシンL型プロテアーゼ前駆体と新規な構造の26kDaサブユニットとがタンデムに結合した形の前駆体蛋白として合成され、(2)それが後に切断をうけて26kDaと29kDaの2つのサブユニットになり、(3)それらが会合することで形成されるものと考察された(Fig.2)。 このように、1つの前駆体からプロテアーゼサブユニットとプロテアーゼとは明らかに異なる構造のサブユニットの、2つのサブユニットが生じるタイプのシステインプロテアーゼはほとんど例がなく、他にはカテプシンCが報告されているのみである。26・29kDaプロテアーゼはカテプシンCとは異なる構造をしており、新規な2分子性のプロテアーゼと考えられた。 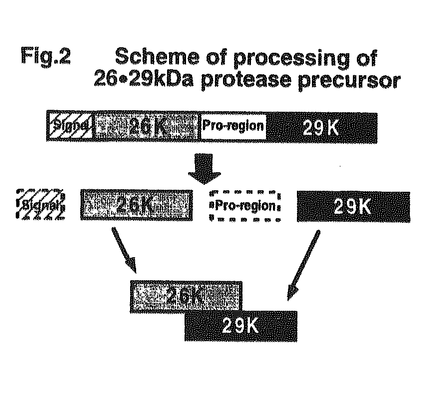 Fig.2 Scheme of processing of 26・29kDa protease precursor(II)26・29kDaプロテアーゼはカテプシンB様の基質特異性をもつカテプシンL様構造のプロテアーゼである。 Fig.2 Scheme of processing of 26・29kDa protease precursor(II)26・29kDaプロテアーゼはカテプシンB様の基質特異性をもつカテプシンL様構造のプロテアーゼである。 26・29kDaプロテアーゼは構造的にはカテプシンLに近いが、哺乳類カテプシンBに特徴的な基質であるZ-Arg-Arg-MCAを加水分解し、カテプシンB様の基質特異性を有していた。このことから、26・29kDaプロテアーゼは活性の面からも新しいプロテアーゼと考えられた。その一方でセンチニクバエ体液細胞由来のカテプシンBは、Z-Arg-Arg-MCAを水解せず、哺乳類のカテプシンBとは基質特異性が異なっていた。これらの点から、センチニクバエではシステインプロテアーゼの性質が哺乳類のものとは一部異なっていると考えられた。 (III)26・29kDaプロテアーゼは、発生過程にも発現している。 センチニクバエの26・29kDaプロテアーゼの機能する時期を知る目的で発生の各時期のRNAについてノザンブロット解析をおこなった。その結果、26・29kDaプロテアーゼのmRNAは蛹後期及び胚発生初期、中期に強く発現していた(Fig.3)。さらに、胚発生過程における26・29kDaプロテアーゼの蛋白の発現をしらべたところ、発生初期に一過的な発現の上昇がみられ、26・29kDaプロテアーゼが発生過程に機能している可能性が考えられた。センチニクバエではカテプシンB及びカテプシンLの発現が胚発生期に一過的に上昇することが既に示されており、今回の知見も含めると、センチニクバエの胚発生では少なくとも3種類のシステインプロテアーゼが関与していることが示唆された。  Fig.3 Northern blot analysis of 26・29kDa protease(IV)26・29kDaプロテアーゼは、昆虫界に広く保存されている。 Fig.3 Northern blot analysis of 26・29kDa protease(IV)26・29kDaプロテアーゼは、昆虫界に広く保存されている。 この、26・29kDaプロテアーゼが他の生物種においても保存されているかどうかを知る目的で26・29kDaプロテアーゼのホモローグの単離をこころみた。その結果、PCR法により、ショウジョウバエとワモンゴキブリから26・29kDaプロテアーゼのホモローグの一部とみられるcDNA断片が単離された(Fig.4)。この結果は、26・29kDaプロテアーゼが完全変態昆虫と不完全変態昆虫の両方に存在することを示しており、このプロテアーゼが昆虫界に広く保存されたプロテアーゼであると考えられた。そして、このプロテアーゼの起源は不完全変態昆虫と完全変態昆虫とが分岐したおよそ3億年前か、あるいはそれ以前と予想された。また、このプロテアーゼに特有な26kDaサブユニットが構造的によく保存されていることから、このサブユニットはこのプロテアーゼの機能に何らかの重要な意味をもつものと考えられた。  Fig.4 Amino acid alignment of 26・29kDa protease precursor from flesh fly,fruit fly and cockroach Fig.4 Amino acid alignment of 26・29kDa protease precursor from flesh fly,fruit fly and cockroach さらに、ショウジウバエの26・29kDaプロテアーゼについては遺伝子座の決定を行った。ショウジョウバエ3齢幼虫唾液腺染色体へジゴキシゲニン標識したショウジョウバエ26・29kDaプロテアーゼのcDNAをハイブリダイズさせることで26・29kDaプロテアーゼの遺伝子座を70C座と同定した。ショウジョウバエカテプシンLの遺伝子座は既に50C座と同定されており、2つの遺伝子は異なる座位に存在することがわかった。 【まとめ】 私は昆虫のプロテアーゼに着目することで、プロテアーゼの新たな性質を見いだせるのではないかと考え、センチニクバエ由来のユニークなシステインプロテアーゼである26・29kDaプロテアーゼの解析をおこなった。このプロテアーゼのcDNAを単離することで1次構造を明らかにした結果、このプロテアーゼがカテプシンL様の29kDaサブユニットと、新規な構造の26kDaサブユニットの2つのサブユニットから構成されており、しかも、これらの2つのサブユニットが1つの前駆体蛋白からプロセスされて生じることを示した。このプロテアーゼはカテプシンL様の構造をしているにもかかわらず、基質特異性はカテプシンBに類似していた。これらの結果から、26・29kDaプロテアーゼは構造的にも活性的にもこれまでに報告のない新しいプロテアーゼであると結論された。さらに、ホモログの単離により、この新規なプロテアーゼが昆虫において広く保存されている可能性を示した。今後は、このプロテアーゼの機能を解明することが重要な課題である。 |