[結果と考察] 1.キノンアナログ耐性変異株の単離と解析:修士課程においてチトクロムbo複合体の基質酸化反応の阻害によって大腸菌の好気的増殖を抑制するキノンアナログとして、2種の置換フェノール(PC15:2,6-dichloro-4-nitrophenol、PC16:2,6-dichloro-4-dicyanovinylphenol)と1種のベンゾキノン(DMBQ:2,6-dimethyl-1,4-benzoquinone)(Sato-Watanabeら,1994a、図2)を同定した。そこで、これらのキノンアナログに対する耐性変異株を単離し、生化学的解析と変異部位の同定を行なった。PC15,PC16およびDMBQをそれぞれ終濃度200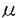 M,100
M,100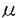 M,20
M,20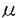 M加えた最小培地で、末端酸化酵素を欠失したST2592株(
M加えた最小培地で、末端酸化酵素を欠失したST2592株( cyo
cyo cyd)にチトクロムbo複合体を発現する単コピープラスミドpMFO4(cyo+)を導入したST2592/pMFO4を培養し、耐性変異株を単離した。この培地で野生株は生育できないが、自然突然変異体の出現によって3〜5日後に好気的増殖が確認できるようになる。プラスミドpMFO4に表現型が依存する変異株を選択し、PC15とPC16からそれぞれ10株、DMBQから5株のキノンアナログ耐性変異株を得た。変異株の好気的増殖能に対するキノンアナログの抑制効果を検討したところ、全ての置換フェノール耐性変異株はPC15,PC16のどちらに対しても耐性である一方、5株(PC15-S3,-S10,PC16-S8,-S9,-S10)を除いてDMBQ感受性であること、逆にDMBQ耐性変異株はDMBQ-S2を除いてPC15,PC16のいずれに対しても耐性を獲得していないことがわかった。変異株から調製した膜標品のユビキノール酸化活性に対するキノンアナログの影響を検討した場合にも同様の結果が得られることから(表1)、置換フェノールとベンゾキノンは共にユビキノールの競合阻害剤であるが、結合部位は同一ではないと考えられる。
cyd)にチトクロムbo複合体を発現する単コピープラスミドpMFO4(cyo+)を導入したST2592/pMFO4を培養し、耐性変異株を単離した。この培地で野生株は生育できないが、自然突然変異体の出現によって3〜5日後に好気的増殖が確認できるようになる。プラスミドpMFO4に表現型が依存する変異株を選択し、PC15とPC16からそれぞれ10株、DMBQから5株のキノンアナログ耐性変異株を得た。変異株の好気的増殖能に対するキノンアナログの抑制効果を検討したところ、全ての置換フェノール耐性変異株はPC15,PC16のどちらに対しても耐性である一方、5株(PC15-S3,-S10,PC16-S8,-S9,-S10)を除いてDMBQ感受性であること、逆にDMBQ耐性変異株はDMBQ-S2を除いてPC15,PC16のいずれに対しても耐性を獲得していないことがわかった。変異株から調製した膜標品のユビキノール酸化活性に対するキノンアナログの影響を検討した場合にも同様の結果が得られることから(表1)、置換フェノールとベンゾキノンは共にユビキノールの競合阻害剤であるが、結合部位は同一ではないと考えられる。
次にユビキノール酸化活性およびPC15,DMBQの酵素阻害活性を速度論的に解析したところ、全ての変異株のKm値に大きな変化は見られなかった。9株はPC、DMBQに対するKi値が変化しており、変異部位はQL部位とPC結合部位の近傍に存在すると考えられる。16株はPC15もしくはDMBQのどちらか一方のKi値が増加していることから、一方の結合のみに関与する部位に変異を持つと考えられる。以上の結果、今回単離した変異株の変異部位はユビキノールの結合に関与するアミノ酸残基ではないが、その近傍でPC、DMBQの結合に影響を与えると考えられる。
そこで表現型の異なる変異株(PC15-S3,-S5,-S8,-S10,PC16-S3,-S8,-S10,DMBQ-S4)を選んで変異酵素のcyo領域を制限酵素で切断し、断片を野生型cyoオペロンにサブクローニングして相補性試験によって変異部位を含む領域を検討したところ、全ての株の変異部位がサブユニットIIに存在することが確認された(図3(A))。表現型に関わらず変異部位がサブユニットIIに局在することから、ユビキノール酸化部位はサブユニットIIに存在すると考えられる。この結果は光親和性キノンアナログがサブユニットIIに結合する(Welterら、1994)という結果とも一致する。また、PC15-S5,PC16-S6の変異部位は、S258NおよびQ233Hと同定された。このアミノ酸残基は、チトクロムc酸化酵素のCuA結合部位を構成するCupredoxinドメインよりC末端側の、キノール酸化酵素に特異的なドメインに存在することから、両酵素が親水性の異なる基質から電子を取り出すためにサブユニットIIの親水性ドメインを使い分けており、電子取り込み部位からサブユニットIの低スピンヘムへの電子伝達機構が異なることが示唆された。
2.高親和性キノン結合部位(QH部位)の電子伝達への関与: QH部位は私の修士課程における研究で初めて発見された高親和性キノン結合部位で、QL部位と低スピンヘムbの近傍に存在することから、分子内電子伝達を媒介すると考えられる(Sato-Watanabeら、1994b)。本研究ではQH部位に結合するユビキノンと金属中心の酸化還元電位の解析およびQH部位の再構成実験を行った。
1)酸化還元電位の決定:野生型酵素をポリエチレングリコール沈殿後、透析して遊離のユビキノンを除去し、1分子のユビキノン-8を結合する酵素標品を得た。この標品を用いて嫌気条件下、フェリシアナイド/ジチオナイト系で酸化還元滴定を行った。まず、EPRを用いて、0mV、g=2でセミキノンシグナルが現われることを見いだした(図4(A))。ユビキノン生合成欠損変異株( ubiA)から調製した
ubiA)から調製した UbiA酵素ではシグナルが観察されないことから(図4(C))、シグナルがユビセミキノンに由来することを示した。このシグナルはQL部位の競合阻害剤であるPC16を過剰に添加しても変化しないことから(図4(B))、セミキノンはQL部位ではなく、QH部位で安定化されていることが確かめられた。
UbiA酵素ではシグナルが観察されないことから(図4(C))、シグナルがユビセミキノンに由来することを示した。このシグナルはQL部位の競合阻害剤であるPC16を過剰に添加しても変化しないことから(図4(B))、セミキノンはQL部位ではなく、QH部位で安定化されていることが確かめられた。
次に、セミキノンシグナル(g=2.0)と低スピンヘムシグナル(g=3.0)をpH=8.5で酸化還元滴定した。電位の上昇に従ってシグナル強度が増加するユビキノール→セミキノンの反応と、電位の上昇に従ってシグナル強度が減少するセミキノン→ユビキノンの反応からなるベル型の滴定曲線が得られ(図5)、ネルンストの式を用いて酸化還元電位はそれぞれ-13mV,+10mV、2電子反応(ユビキノン/ユビキノール)の酸化還元電位は約-2mVと算出された。g=3.0シグナルは1成分のみを含み、酸化還元電位は+70mVであった。従ってQH部位の酸化還元電位は低スピンヘムbより低く、電位的にはQH部位のユビキノンがヘムbに電子を伝達しうることが示された。
2)QH部位再構成標品のユビキノール酸化活性: UbiA酵素のQH部位にキノンアナログを再構成してユビキノール酸化活性を野生型酵素と比較し、QH部位の電子伝達への関与を検討した。まず、28種類の置換フェノールを用いてQ1H2酸化活性におよぼすI50値を検討し、野生型酵素より大きいI50値を示す、すなわちQH部位に親和性を持つ化合物のスクリーニングを行い、PC24(2,4-dinitro-6-chlorophenol)、PC32(2,6-dibromo-4-cyanophenol)、PC52(2,4-dinitro-3-methyl-6-isopropylphenol)を同定した。次に5
UbiA酵素のQH部位にキノンアナログを再構成してユビキノール酸化活性を野生型酵素と比較し、QH部位の電子伝達への関与を検討した。まず、28種類の置換フェノールを用いてQ1H2酸化活性におよぼすI50値を検討し、野生型酵素より大きいI50値を示す、すなわちQH部位に親和性を持つ化合物のスクリーニングを行い、PC24(2,4-dinitro-6-chlorophenol)、PC32(2,6-dibromo-4-cyanophenol)、PC52(2,4-dinitro-3-methyl-6-isopropylphenol)を同定した。次に5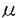 Mの
Mの UbiA酵素に終濃度0.5
UbiA酵素に終濃度0.5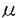 M〜100
M〜100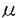 Mの置換フェノールを加え、一晩氷上に静置した後に酸化型の絶対スペクトルを測定し、Soret帯吸収ピークの吸光度差(再構成標品と野生型酵素;409nm、
Mの置換フェノールを加え、一晩氷上に静置した後に酸化型の絶対スペクトルを測定し、Soret帯吸収ピークの吸光度差(再構成標品と野生型酵素;409nm、 UbiA酵素:412nm)を用いて結合反応の解析を行った。PC32とPC52では、ユビキノン-1(Q1)のKd値(2.1
UbiA酵素:412nm)を用いて結合反応の解析を行った。PC32とPC52では、ユビキノン-1(Q1)のKd値(2.1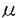 M)よりも低い0.3
M)よりも低い0.3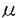 M、0.5
M、0.5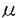 Mであることが判明した(図6)。そこで終濃度100
Mであることが判明した(図6)。そこで終濃度100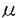 MのPC32もしくはPC52を10
MのPC32もしくはPC52を10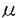 M
M UbiA酵素溶液に加えてQH部位に再構成をし、透析によって遊離の置換フェノールを除いた後にユビキノール酸化活性を測定したところ、PC32,PC52再構成標品のユビキノール酸化活性のVmax値がそれぞれ1/10,1/4に減少していることが明らかになった(図7)。野生型酵素とPC32再構成標品を1:10で混ぜても野生型標品の活性が阻害されないことから、PC32再構成標品のVmax値の減少は、遊離の阻害剤によるものではないことが確認された(図7)。従ってQH部位に置換フェノールを導入したため、QL部位と低スピンヘムb間の電子伝達が妨げられ、酵素活性が低下したと考えられる。以上の結果から、QH部位が分子内電子伝達に関与している可能性が強く示された。
UbiA酵素溶液に加えてQH部位に再構成をし、透析によって遊離の置換フェノールを除いた後にユビキノール酸化活性を測定したところ、PC32,PC52再構成標品のユビキノール酸化活性のVmax値がそれぞれ1/10,1/4に減少していることが明らかになった(図7)。野生型酵素とPC32再構成標品を1:10で混ぜても野生型標品の活性が阻害されないことから、PC32再構成標品のVmax値の減少は、遊離の阻害剤によるものではないことが確認された(図7)。従ってQH部位に置換フェノールを導入したため、QL部位と低スピンヘムb間の電子伝達が妨げられ、酵素活性が低下したと考えられる。以上の結果から、QH部位が分子内電子伝達に関与している可能性が強く示された。