序説(Introduction): 認知・記憶の障害は、未だ決定的解決を得ない神経薬理学的問題である。その解決へのアプローチの一つとして、伝統医薬によって得られる知識がある。このアプローチにより私は、特定の真菌由来の化合物が末梢性に働いて、記憶と関連すると考えられている細胞機能を著しく促進することを見いだした。また、その作用には、おそらく副腎が関与しているものと考えられた(Biol. Pharm.Bull.18;1995:518-522;Pharm.Res.13;1996:1322-1326)。
実際に、皮質から放出された副腎ステロイド類と副腎髄質ホルモンであるエピネフリン(EPI)は、認知能力を含む脳機能に影響を与えることが報告されている。
副腎ホルモン類の中枢神経系への影響は非常に複雑で多様である。このため、記憶の基礎をなす分子メカニズムと考えられている海馬でのシナプス可塑性に対する副腎ホルモンの作用について、ここでは薬理学的側面についての詳述は避け、専らそれらの生理学的作用について述べることにする。
実験の評価と結果(Experimental Evaluations and Results): 海馬歯状回における電気生理学的な記録応答を得るために、私は個体レベル(in vivo)での実験系を用いた。In vivo実験系では、研究対象部位から他の脳部位、または末梢への神経回路を切り離すことなく、比較的生体に近い状態での実験操作が可能である。歯状回における興奮性シナプスに高頻度刺激(tetanus)を与えると、神経伝達が長期的に増強することが知られており、このシナプスの可塑性が、実際の記憶・学習の基礎をなす分子メカニズムと考えられている。そこで私は、海馬歯状回における電気性理学的検討を行った。
電気的に誘発して記録される応答は、集合スパイクが重なりあった場電位であり、これをFig.1上部に示す。テスト刺激は、それぞれ1個の電流刺激からなり、30秒毎に1回の間隔で与えた。60分間の安定した応答(basal)を得た後、60Hz20発または30発という高頻度のテタヌス刺激を与え、引き続く集合電位の変化を、活性依存的なシナプス可塑性のモデルとした。Fig.1内に示したように、集合電位の潜時(latency)は記録された場電位の波形から直接測定し、その振幅は"a"と"b"の平均値を計算して求めた。記録応答はテタヌス強度に依存しており定量的にも差異が生じたため、それぞれの応答に対応するテタヌス条件を弱、または強テタヌスと記述した。電気生理学的測定を行う前に、あらかじめ動物に副腎摘出手術(ADX)または偽手術(SHAM)を施行した。副腎摘出の精度は血漿中のコルチコステロン(CORT)濃度を蛍光定量することで確認した。
副腎摘出7日後のラットでは強テタヌスにより誘発するシナプス増強が顕著に抑制されることを見いだした(Fig.1A)。これは、弱テタヌスによるシナプス増強においては認められなかった(図は省略)。強テタヌスによる抑制は、集合スパイクの潜時の延長からもわかるように、副腎摘出ラット歯状回における神経興奮性の顕著な減少を伴った。偽手術ラットへのグルココルチコイドCORT(sc,40mg/kg)の単回投与でも、同様の抑制効果が認められた(Fig.1B)。一方、CORTは、副腎摘出ラットの強テタヌスによるシナプス増強の抑制応答を顕著に回復させる(Fig.1B)。Fig.1Aの影の部分で示された曲線下の面積を、テタヌス後の増強の総合的な変化の指標とした。以上の結果から、CORTの血漿中濃度は低過ぎても高過ぎても、歯状回におけるシナプス可塑性に抑制的に働くことが示唆された。
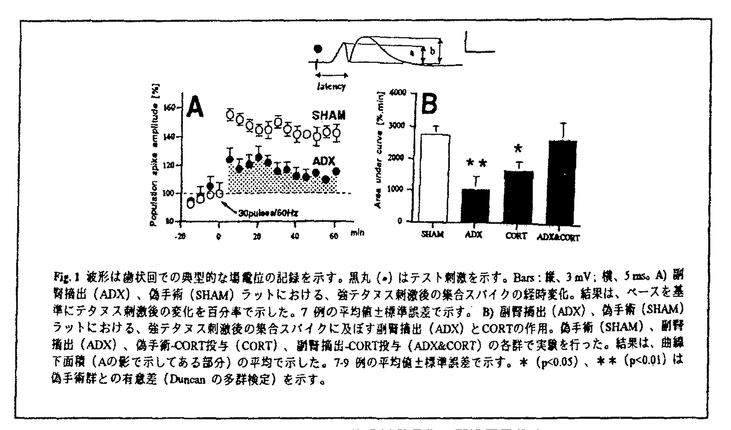 Fig.1波形は歯状回での典型的な場電位の記録を示す。黒丸(●)はテスト刺激を示す。Bars:縦、3mV;横、5ms。A)副腎摘出(ADX)、偽手術(SHAM)ラットにおける、強テタヌス刺激後の集合スパイクの経時変化。結果は、ペースを基準にテタヌス刺激後の変化を百分率で示した。7例の平均値±標準誤差で示す。B)副腎摘出(ADX)、偽手術(SHAM)ラットにおける、強テタヌス刺激後の集合スパイクに及ぼす副腎摘出(ADX)とCORTの作用。偽手術(SHAM)、副腎摘出(ADX)、偽手術-CORT投与(CORT)、副腎摘出-CORT投与(ADX&CORT)の各群で実験を行った。結果は、曲線下面積(Aの影で示してある部分)の平均で示した。7-9例の平均値±標準誤差で示す。*(p<0.05)、**(p<0.01)は偽手術群との有意差(Duncanの多群検定)を示す。
Fig.1波形は歯状回での典型的な場電位の記録を示す。黒丸(●)はテスト刺激を示す。Bars:縦、3mV;横、5ms。A)副腎摘出(ADX)、偽手術(SHAM)ラットにおける、強テタヌス刺激後の集合スパイクの経時変化。結果は、ペースを基準にテタヌス刺激後の変化を百分率で示した。7例の平均値±標準誤差で示す。B)副腎摘出(ADX)、偽手術(SHAM)ラットにおける、強テタヌス刺激後の集合スパイクに及ぼす副腎摘出(ADX)とCORTの作用。偽手術(SHAM)、副腎摘出(ADX)、偽手術-CORT投与(CORT)、副腎摘出-CORT投与(ADX&CORT)の各群で実験を行った。結果は、曲線下面積(Aの影で示してある部分)の平均で示した。7-9例の平均値±標準誤差で示す。*(p<0.05)、**(p<0.01)は偽手術群との有意差(Duncanの多群検定)を示す。 ミネラルコルチコイドは副腎ステロイド類の2つ目のグループに含まれる。主要なミネラルコルチコイドであるアルドステロン(ALDO)(sc,100 g/kg)は、偽手術ラットに強テタヌス(図は省略)、または弱テタヌス(Fig.2A)を与えることで誘発されるシナプス増強に影響しなかった。しかし、副腎摘出ラットのシナプス可塑性に対しては、顕著な増強作用を有した(Fig.2A)。Fig.2BでALDOは潜時を短縮させたことから、ALDOによるシナプス可塑性の増強作用は、神経興奮性の増大に起因していることが示された。ALDOの効果はどちらも、ミネラルコルチコイド受容体拮抗薬であるスピロノラクトンにより消失した(Fig.2)ことからも、受容体の関与が強く示唆された。
g/kg)は、偽手術ラットに強テタヌス(図は省略)、または弱テタヌス(Fig.2A)を与えることで誘発されるシナプス増強に影響しなかった。しかし、副腎摘出ラットのシナプス可塑性に対しては、顕著な増強作用を有した(Fig.2A)。Fig.2BでALDOは潜時を短縮させたことから、ALDOによるシナプス可塑性の増強作用は、神経興奮性の増大に起因していることが示された。ALDOの効果はどちらも、ミネラルコルチコイド受容体拮抗薬であるスピロノラクトンにより消失した(Fig.2)ことからも、受容体の関与が強く示唆された。
 Fig.2A)副腎摘出(ADX)ラットにおけるAldosterone(ALDO)(sc,100
Fig.2A)副腎摘出(ADX)ラットにおけるAldosterone(ALDO)(sc,100 g/kg)の弱テタヌス刺激(60Hz,20発)誘発集合スパイク電位促進作用。Aldosteroneの作用は、spironolactone(spiron.)の10分前投与(sc,20mg/kg)によって消失した。5例の平均値±標準誤差で示す。**(p<0.01)は他の全ての群との有意差(Duncanの多群検定)を示す。B)副腎摘出(ADX)ラットにおけるAldosterone(ALDO)(sc,100
g/kg)の弱テタヌス刺激(60Hz,20発)誘発集合スパイク電位促進作用。Aldosteroneの作用は、spironolactone(spiron.)の10分前投与(sc,20mg/kg)によって消失した。5例の平均値±標準誤差で示す。**(p<0.01)は他の全ての群との有意差(Duncanの多群検定)を示す。B)副腎摘出(ADX)ラットにおけるAldosterone(ALDO)(sc,100 g/kg)の集合スパイク潜時延長作用。Aldosteroneの作用は、spironolactone(spiron.)の10分前投与(sc,20mg/kg)によって消失した。5例の平均値±標準誤差で示す。*(p<0.05)、**(p<0.01)は他の全ての群との有意差(Duncanの多群検定)を示す。
g/kg)の集合スパイク潜時延長作用。Aldosteroneの作用は、spironolactone(spiron.)の10分前投与(sc,20mg/kg)によって消失した。5例の平均値±標準誤差で示す。*(p<0.05)、**(p<0.01)は他の全ての群との有意差(Duncanの多群検定)を示す。 エピネフリンEPIもまた、歯状回におけるシナプス伝達の調節物質の1つである。私は、EPI(ip,100 g/kg)の単回投与により、副腎摘出ラット、偽手術ラットの両群において、テタヌス誘導シナプス応答が顕著に増強されること、また、この作用がプロプラノロール感受性
g/kg)の単回投与により、副腎摘出ラット、偽手術ラットの両群において、テタヌス誘導シナプス応答が顕著に増強されること、また、この作用がプロプラノロール感受性 -アドレナージック系を介することを見いだした(図は省略)。さらに、
-アドレナージック系を介することを見いだした(図は省略)。さらに、 -アドレナージック系は、直接的なシナプス効率の調節だけでなく、歯状回におけるミネラルコルチコイドの作用発現にも必要であることを明らかにした。プロプラノロールはALDOによるシナプス可塑性増強の促進効果を部分的に阻害し(Fig.3A)、神経興奮性に対する影響を顕著に阻害した(Fig.3B)。プロプラノロールは、海馬に直接投与したときのみ有効で、扁桃体への投与では無効であった(Fig.3)ことから、歯状回内で
-アドレナージック系は、直接的なシナプス効率の調節だけでなく、歯状回におけるミネラルコルチコイドの作用発現にも必要であることを明らかにした。プロプラノロールはALDOによるシナプス可塑性増強の促進効果を部分的に阻害し(Fig.3A)、神経興奮性に対する影響を顕著に阻害した(Fig.3B)。プロプラノロールは、海馬に直接投与したときのみ有効で、扁桃体への投与では無効であった(Fig.3)ことから、歯状回内で -アドレナージックとミネラルコルチコイド受容体の介する機構が、直接相互作用しているものと考えられる。
-アドレナージックとミネラルコルチコイド受容体の介する機構が、直接相互作用しているものと考えられる。
 Fig.3A)副腎摘出(ADX)ラットにおける弱テタヌス刺激(60Hz,20発)誘発集合スパイクに及ぼすaldosterone(sc,100
Fig.3A)副腎摘出(ADX)ラットにおける弱テタヌス刺激(60Hz,20発)誘発集合スパイクに及ぼすaldosterone(sc,100 g/kg)の作用は、歯状回へのpropranolol(9nmol)前投与で部分的に抑制されるが、扁桃体への投与では抑制されない。4-6例の平均値±標準誤差で示す。*(p<0.05)は、saline投与群との有意差(Duncanの多群検定)を示す。B)副腎摘出(ADX)ラットにおける集合スパイク潜時に及ぼすaldosterone(sc,100
g/kg)の作用は、歯状回へのpropranolol(9nmol)前投与で部分的に抑制されるが、扁桃体への投与では抑制されない。4-6例の平均値±標準誤差で示す。*(p<0.05)は、saline投与群との有意差(Duncanの多群検定)を示す。B)副腎摘出(ADX)ラットにおける集合スパイク潜時に及ぼすaldosterone(sc,100 g/kg)の作用は、歯状回へのpropranolol(9nmol)前投与で有意に抑制されるが、扁桃体への投与では抑制されない。4-6例の平均値±標準誤差で示す。*(p<0.05)は、saline投与群との有意差(Duncanの多群検定)を示す。総括(summary):
g/kg)の作用は、歯状回へのpropranolol(9nmol)前投与で有意に抑制されるが、扁桃体への投与では抑制されない。4-6例の平均値±標準誤差で示す。*(p<0.05)は、saline投与群との有意差(Duncanの多群検定)を示す。総括(summary): 海馬歯状回における副腎ステロイド類の作用は、多様であることが示された。
グルココルチコイド(CORT)は健常ラットにおいて、テタヌス誘発シナプス可塑性を抑制したが、CORTの血中における通常濃度での存在はテタヌス誘発シナプス可塑性に必要である。
ミネラルコルチコイド(ALDO)は、副腎摘出ラットにおいて、テタヌス誘発シナプス可塑性を促進したが、偽手術ラットでは促進しなかった。このミネラルコルチコイドが介するメカニズムに、海馬での -アドレナージック系が関与することが示唆された。
-アドレナージック系が関与することが示唆された。
以上の結果から、海馬でのシナプス可塑性において、多様な副腎内分泌系が相互作用していることが示唆された。