生理的条件下で難溶性であることが細胞外マトリクスの三次元構造体が細胞の足場、支持体として機能する上では不可欠である。近年、特に注目されている細胞接着による細胞機能の制御作用物質としての細胞外マトリクスは生理的条件下で難溶性の固相を形成していることが一つの重要な特徴である。生理的条件下での細胞外マトリクス成分の溶解性の変化に伴う液相から固相への移行過程は細胞外マトリクスの三次元立体構造構築過程において最も重要な段階の一つである。なぜならば、生理的条件下において、各細胞外マトリクス成分の溶解度が部位によって制御されることによって細胞外マトリクスの部位による分布の特異性が実現されているはずだからである。すなわち、時と場合によって、各細胞外マトリクス成分は溶けやすく、また、溶けにくい状態で存在する必要がある。各細胞外マトリクス成分の溶解度が部位によってどのように制御されているかが重要である。細胞外マトリクスは固相で機能するため、容易に拡散・分解してしまう液性因子と違って長寿命である。細胞外マトリクス構造体は一般にターンオーバーが遅い。細胞外マトリクス成分の定常状態での流通量は少ない。遺伝子組み換えで細胞外マトリクス成分を大量に発現する方法により細胞外マトリクス会合体形成まで到達するような完成した分子まで生産されることはない。一方、組織からの抽出では生理的条件下で溶けている細胞外マトリクス成分を手に入れることが困難である。液相から固相への移行過程を捉えるための方法論的な限界がある。すなわち、細胞外マトリクス成分が単分散の分子から、会合体へ移行する過程を追跡する実験系が存在しないのである。大量に存在する細胞外マトリクス成分、分けてもI型コラーゲンの液相から固相への移行過程機構については、プロコラーゲンの単離とプロコラーゲンプロテアーゼによる特異的なプロセシングをin vitroで実現させているが、I型コラーゲンの系の場合、プロセシング酵素だけであっても、長い間の酵素の精製、性状を検討し、やっと系が確立した段階である。 私はヒトIV型コラーゲンを特異的に認識するモノクローナル抗体を用いたwesterm blottingによってヒト胎児肺由来線維芽細胞TIG-1の培養上清中に検出されるタンパク質の挙動を検討することを計画した。基底膜の主要構成成分であるIV型コラーゲンがin vivoでは結合組織に存在する線維芽細胞によって酵素抗体法であるWesterm blottingで存在を確認できるレベル、すなわち、タンパク質として取り扱いうるレベルの量が合成される。IV型コラーゲンの液相から固相への移行過程を追求できる実験系を作成すべく、以下の研究を行った。 第1章ではIV型コラーゲンが不溶化して線維芽細胞の長期培養により形成される細胞層中に存在するかを定量的に評価することを考え、定量法について検討した。細胞外マトリクス成分全般にいえることであるが、一旦、固相を形成したものの全量を再可溶化することは非常に困難である。線維性コラーゲンが主要構成成分であると考えられる細胞層中の微量成分と予想されるIV型コラーゲンの特異的抽出法は現在までに知られていない。したがって、液相に存在するタンパク質の定量分析には有効な種々の生化学的手法は前段階として必要なIV型コラーゲンの再可溶化が困難であるために全く用いることができない。酵素抗体法のひとつであるELISAはプラスチックのplate上に吸着させ、固相化した抗原量を定量する方法である。IV型コラーゲンの可溶化操作を必要としない、また、特異性の高い定量法を確立できないかと考え、固相である細胞層を直接ELISAによって調べるための条件検討を行った。直接細胞層にELISAを応用するため、抗原性を持たない他の細胞外マトリクス成分に抗体が非特異的に吸着すること、あるいは細胞外マトリクス三次元立体構造の内部に抗体が留まることによって生じるfalse positiveを排除し、plate上の細胞層を損なわない洗浄条件を決定した。このように細胞層に直接ELISAを応用したCLEIA(cell layer enzyme immuno assay)を用いて、細胞層中のIV型コラーゲン量を定量し、細胞培養が長期化するとともに、IV型コラーゲンの蓄積が増加していくことをヒト胎児肺由来線維芽細胞TIG-1の細胞層で観察した。 線維芽細胞周囲へIV型コラーゲンが蓄積したと言ってもこれは単にIV型コラーゲンの溶解度の関係で、次第に沈殿しただけということも考えられる。第2章ではIV型コラーゲンの細胞周囲への蓄積がどのような機構で起きるかを明らかにするべく実験を計画した。 未知の因子を減らすために、ヒト胎児肺由来線維芽細胞TIG-1のTGF- 1添加・無血清培地を用いた培養で得られたIV型コラーゲンが存在する培養上清を用いて蓄積がどのようにして起きるかを明らかにすることにした。 1添加・無血清培地を用いた培養で得られたIV型コラーゲンが存在する培養上清を用いて蓄積がどのようにして起きるかを明らかにすることにした。 細胞外マトリクス成分のひとつフィブロネクチンには液相に存在する血漿フィブロネクチンと固相に存在する細胞フィブロネクチンの二種類の状態がある。生理的条件下で可溶性である血漿フィブロネクチンは細胞表面で分子間で架橋を形成して多量体化し、不溶性の細胞フィブロネクチンになるというモデルが提唱されている。IV型コラーゲンの蓄積に細胞が何らかの役割を果たしているかを見るために遠心によって細胞を除いた培養上清を細胞培養と同じ条件下においたところ、細胞が存在していなくてもIV型コラーゲンの蓄積が見られた。 無細胞系でIV型コラーゲンが蓄積される系での実験を以下に行った。まず、培養上清のpHを変えて蓄積量を見たところ、弱酸性、弱アルカリ性にpHを変えると中性pHに比べて蓄積量は著しく減少した。I型コラーゲンプロセシングで見られるような細胞外での酵素の関与を想定し、培養上清にプロテアーゼ阻害剤を添加して調べたが有意な蓄積量の変化は見られなかった。TGF- 1添加・無血清培地を用いた培養で得られた培養上清にウシ胎児血清を添加したところIV型コラーゲンの蓄積量が減少した。蓄積量の減少はIV型コラーゲンよりもウシ胎児血清中の成分が早く沈着したためとも考えられたので、培養上清にウシ胎児血清を添加した場合とウシ血清由来アルブミンを添加した場合の蓄積量を比較した。ウシ血清由来アルブミンを添加した場合のIV型コラーゲン蓄積量の減少は少なかったことから、沈着の競争によるものではない。IV型コラーゲンの蓄積は自発的にすすむか、あるいは促進する因子が培養上清中に存在し、その効果を抑制する因子がウシ胎児血清中に存在し相互作用の結果、IV型コラーゲン蓄積量の減少が起きたものと考えた。 1添加・無血清培地を用いた培養で得られた培養上清にウシ胎児血清を添加したところIV型コラーゲンの蓄積量が減少した。蓄積量の減少はIV型コラーゲンよりもウシ胎児血清中の成分が早く沈着したためとも考えられたので、培養上清にウシ胎児血清を添加した場合とウシ血清由来アルブミンを添加した場合の蓄積量を比較した。ウシ血清由来アルブミンを添加した場合のIV型コラーゲン蓄積量の減少は少なかったことから、沈着の競争によるものではない。IV型コラーゲンの蓄積は自発的にすすむか、あるいは促進する因子が培養上清中に存在し、その効果を抑制する因子がウシ胎児血清中に存在し相互作用の結果、IV型コラーゲン蓄積量の減少が起きたものと考えた。 培養上清中に存在するIV型コラーゲンがどのような構造をしているのか、細胞層中に存在し、JK199と反応するIV型コラーゲンとどのような関係があるのかを解明するために、培養上清からIV型コラーゲンを単離することを第3章で試みた。モノクローナル抗体JK199固定化アフィニティカラムを作製し、培養上清からIV型コラーゲンを単離した。培養上清から単離したIV型コラーゲン量から、培養上清中のIV型コラーゲン濃度は1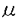 g/mlと見積もられた。培養上清から単離されたIV型コラーゲンは単分子分散していて、 g/mlと見積もられた。培養上清から単離されたIV型コラーゲンは単分子分散していて、 1(IV)鎖2本と 1(IV)鎖2本と 2(IV)鎖1本から構成されるヘテロトライマー[ 2(IV)鎖1本から構成されるヘテロトライマー[ 1(IV)]2 1(IV)]2 2(IV)と考えられるものであった。また、組織、細胞層より非酵素的に抽出したIV型コラーゲンに含まれている短鎖型の 2(IV)と考えられるものであった。また、組織、細胞層より非酵素的に抽出したIV型コラーゲンに含まれている短鎖型の (IV)鎖は、培養上清から単離したIV型コラーゲンには含まれていなかった。 (IV)鎖は、培養上清から単離したIV型コラーゲンには含まれていなかった。 細胞層への蓄積に先立ち、培養上清中にIV型コラーゲンが検出される。このことからヒト胎児肺由来線維芽細胞TIG-1が合成したIV型コラーゲンは最初に培養上清中に分泌され、しばらく可溶性のタンパク質として培養上清中にとどまったあとで細胞層中に移行するという仮説をたてた。培養上清中のIV型コラーゲンについては1)単分子である、2)短鎖型の (IV)鎖が存在していない、3)生理的条件下で可溶性のタンパク質であるという特徴が挙げられる。一方、細胞層中のIV型コラーゲンについては1)会合体を形成している、2)長鎖型の (IV)鎖が存在していない、3)生理的条件下で可溶性のタンパク質であるという特徴が挙げられる。一方、細胞層中のIV型コラーゲンについては1)会合体を形成している、2)長鎖型の (IV)鎖に加えて短鎖型の (IV)鎖に加えて短鎖型の (IV)鎖が存在することが特徴である。これらの特徴の相違はTIG-1が合成したIV型コラーゲンは培養上清中から細胞層中へと移行する、すなわち培養上清中のIV型コラーゲン単分子は細胞層中に存在するIV型コラーゲンの前駆物質であることを示している。 (IV)鎖が存在することが特徴である。これらの特徴の相違はTIG-1が合成したIV型コラーゲンは培養上清中から細胞層中へと移行する、すなわち培養上清中のIV型コラーゲン単分子は細胞層中に存在するIV型コラーゲンの前駆物質であることを示している。 IV型コラーゲンの合成、分泌、会合体形成そして基底膜構築においてこれまでIV型コラーゲンの液相から固相への移行過程、すなわち、分泌された可溶性のIV型コラーゲンがどのような構造であり、どのような変化を経て不溶化して沈着するのかについて調べる実験系が存在しなかった。ヒト胎児肺由来線維芽細胞TIG-1の培養上清から単離したIV型コラーゲン単分子は液相に存在するIV型コラーゲンを単離したものであり、細胞層という固相に移行するポテンシャルを持った前駆物質であった。本研究により、初めてIV型コラーゲンの液相から固相への移行過程について調べる実験系が構築された。 IV型コラーゲンは会合して網目構造を構築する。マウスEHS腫瘍由来のIV型コラーゲンから再構築した網目構造の網目の大きさは200nm程度であるとYurchencoらが報告している。ウシレンズカプセルから酢酸抽出したIV型コラーゲンから再構築した網目構造の網目の大きさは20nmよりも小さいとAdachiら、Nakazatoらは報告している。由来した動物の違いのほかにマウスEHS腫瘍由来のIV型コラーゲンには短鎖型 (IV)鎖は含まれていないが、ウシレンズカプセル酢酸抽出IV型コラーゲンには短鎖型 (IV)鎖は含まれていないが、ウシレンズカプセル酢酸抽出IV型コラーゲンには短鎖型 (IV)鎖は含まれているという違いがある。培養上清から単離した短鎖型 (IV)鎖は含まれているという違いがある。培養上清から単離した短鎖型 (IV)鎖を含まないIV型コラーゲン単分子を試料とすることで、網目構造の網目の大きさの違いが短鎖型 (IV)鎖を含まないIV型コラーゲン単分子を試料とすることで、網目構造の網目の大きさの違いが短鎖型 (IV)鎖の存在に起因するものなのかどうかを検討することができる。特にIV型コラーゲン単分子画分単独で網目構造の構築が可能であるのか、その網目の大きさがどのようなものになるかは興味深いところである。 (IV)鎖の存在に起因するものなのかどうかを検討することができる。特にIV型コラーゲン単分子画分単独で網目構造の構築が可能であるのか、その網目の大きさがどのようなものになるかは興味深いところである。 モノクローナル抗体JK132は変性したヒトIV型コラーゲン 1鎖と反応するが未変性のヒトIV型コラーゲンと反応するかわかっていなかった。モノクローナル抗体JK199は基底膜と強く反応することからヒトIV型コラーゲンと反応すると考えられているが、変性したヒトIV型コラーゲンとの反応性が低いためエピトープは決定されていなかった。培養上清から単離したIV型コラーゲン単分子標品とこれを熱処理・還元処理してえられたヒトIV型コラーゲン 1鎖と反応するが未変性のヒトIV型コラーゲンと反応するかわかっていなかった。モノクローナル抗体JK199は基底膜と強く反応することからヒトIV型コラーゲンと反応すると考えられているが、変性したヒトIV型コラーゲンとの反応性が低いためエピトープは決定されていなかった。培養上清から単離したIV型コラーゲン単分子標品とこれを熱処理・還元処理してえられたヒトIV型コラーゲン 1鎖と 1鎖と 2鎖の混合物を用いてモノクローナル抗体JK132は未変性のヒトIV型コラーゲン単分子とは反応しないことがわかった。モノクローナル抗体JK199は変性したヒトIV型コラーゲンとは反応せず未変性のコラーゲンらせん構造を保持したIV型コラーゲン単分子と反応することがわかった。二種のモノクローナル抗体とIV型コラーゲンの反応はIV型コラーゲンの立体構造に依存していた。モノクローナル抗体JK199を固定化したアフィニティカラムは培養上清中の微量成分であるコラーゲンらせん構造を保持した未変性IV型コラーゲン単分子を特異的に単離することのできる方法である。 2鎖の混合物を用いてモノクローナル抗体JK132は未変性のヒトIV型コラーゲン単分子とは反応しないことがわかった。モノクローナル抗体JK199は変性したヒトIV型コラーゲンとは反応せず未変性のコラーゲンらせん構造を保持したIV型コラーゲン単分子と反応することがわかった。二種のモノクローナル抗体とIV型コラーゲンの反応はIV型コラーゲンの立体構造に依存していた。モノクローナル抗体JK199を固定化したアフィニティカラムは培養上清中の微量成分であるコラーゲンらせん構造を保持した未変性IV型コラーゲン単分子を特異的に単離することのできる方法である。 基底膜の構築・維持は基底膜に接している上皮・内皮系の細胞によるもので、結合組織中に存在する線維芽細胞は無関係であると考えられている。ヒト胎児肺由来線維芽細胞TIG-1の培養で、生理的条件下で可溶性のIV型コラーゲンの培養上清中への分泌、不溶化したIV型コラーゲンの細胞層中への蓄積が観察された。本研究の結果から線維芽細胞は基底膜の構築・維持に関与していることが予想される。 |