| 内容要旨 | | 癌遺伝子産物Rasは酵母からヒトに至るまで高度に保存されており,細胞の増殖や分化を制御していることが知られている。通常,非刺激下の細胞ではRasは大部分がGDP結合型として細胞膜に結合して存在している。不活性型であるGDP結合型から活性型であるGTP結合型への転換はGDP/GTP交換反応により行われ,この反応を制御する蛋白質がGDP/GTP交換因子(GEF)である。Ras GEFとしてはCdc25,Sdc25,Ras-GRF,Sosなどが見出されている。GTP結合型からGDP結合型への交換はRas自身のGTPase活性によって行われ,この反応を促進するGTPase活性促進蛋白質(GAP)が存在している。細胞膜受容体から核内へのシグナル伝達において,ligandにより活性化された受容体tyrosine kinaseからRasへのシグナルの伝わり方については,受容体のtyrosine残基がリン酸化され,それにadaptor分子であるGrb2/AshがSH2 domainを介して結合する。adaptor分子のSH3ドメインはSosのproline-rich domainと結合しているために,結果としてSosが細胞膜に動員されることになり,そこに局在するRasに作用して活性化をもたらす,というシステムが確立したものとしてしばしば示されている。ところが最近,Sosの配列でRasの活性化に必要なのはCDC25ドメインとN-末端側領域(PHドメインあるいはDHドメイン)であり,adaptor分子Grb2のSH3ドメインが結合するC-末端側領域はRasの活性化という点ではむしろ阻害的に働くこと,また,これまでGrb2は刺激の有無にかかわらずSosと結合していて,その結合によってSosの活性は変化しないとされていたが,SosとGrb2との結合はリン酸化されたShcがGrb2に結合することによって著しく促進されることが報告された。またSosの活性は非受容体型tyrosine kinase(Fyn)と活性化されたT-cell receptorによって促進されることも報告された。このようにSosによるRasの活性化メカニズムには不明な点が多い。 本研究は細胞外signalからRasに至るシグナル伝達機構の解析に向けて,mouse Sos1(図.1)の多様なdeletion mutantを作成し,in vitro及びin vivoでの実験を行った。まず,mSos1のCDC25ドメインを含む領域をGST融合蛋白質として大腸菌で発現させた後,精製してH-Rasに対する活性を調べた。その結果,アミノ酸残基584-1088番のみからなる融合蛋白質はH-Rasに対して充分なGDP/GTP交換促進活性を示した。これより小さい,アミノ酸残基618-1088番のみからなる融合蛋白質では、報告されているCDC25ドメインをすべて含んでいるにも関わらず、GDP/GTP交換促進活性が検出できなかったことからmSos1の活性にはアミノ酸残基584-617番の領域が重要な機能を担っていることが明らかとなった。その領域について,他のCDC25ドメインの一次配列と比較すると,アミノ酸残基584-617番の領域は保存されていないので,この34個のアミノ酸はSosのGDP/GTP交換活性に特異的な役割を担っていると考えられる。RasのC末端側にはシステイン残基を含むユニークなアミノ酸配列(CAAX;Cはシステイン,Aは脂肪族アミノ酸;Xは任意のアミノ酸)があり,そのシステイン残基にファルネシル基がファルネシル転移酵素によりチオエーテル結合で結合する。この脂質の修飾がRasの機能に重要なことは明らかになっているがmSos1が作用する際にもC-末端の修飾がある方がよく作用することがわかった。Ras-GRFの場合にはRasの修飾の影響がなかったことからCDC25ドメイン中でSos保存されていない領域が修飾の認識に関与していることが予想される。 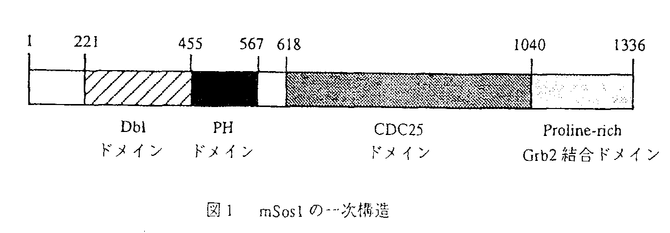 図1 mSos1の一次構造 図1 mSos1の一次構造 次に,細胞内でのmSos1によるRasの活性化メカニズムを調べるために多様なdeletion mutantをHEK293細胞で過剰発現させMAPKの活性化の程度を調べた。mSos1によって活性化したRasはRafを介してMAPKを活性化するのでMAPKの活性を調べることによってmutant mSos1によるRasの活性化の程度を確認することができると考えられる。この方法によって単にmSos1によるRasの活性化だけではなく,実際にmSos1からのシグナルがRasの下流にまで確かに伝えられているかも調べることができる。その結果,これまでの報告と異なり,CDC25ドメインのみからなるmSos1を過剰発現させることで充分にMAPKが活性化することが明らかになった。これは細胞内でmSos1のCDC25ドメインのみで充分にGDP/GTP交換因子として働いていることを意味する。 また,MAPKの活性化という点ではPHドメインとCDC25ドメインからなるmSosl(アミノ酸残基429-1088番)はCDC25ドメインのみのmSoslと同程度であったことからPHドメインはmSoslが細胞内でRas-MAPK経路の活性化に直接には関係していないと考えられる。 Sosを細胞膜につなぐ役割はGrb2結合部位ではなく,PHドメインが担っている可能性が予想されていたが,CDC25ドメインのみからなるmSos1が半分以上膜分画に存在していたことから膜への局在にはCDC25ドメインのみで充分であることが明らかになった。実際,ウェスタンの結果からPHドメインとCDC25ドメインからなるmSos1とCDC25ドメインのみからなるmSos1は膜に存在する量はほぼ同じだった。このことはSosが膜に移動するのにCDC25ドメインが重要な役割を担っていることを示すものである。また,mSos1のGrb2結合部位を欠失させることによって,Ras-MAPK経路の活性化能が上昇することからmSos1のC-末端側領域は阻害的に働いていることを確認した。 また, -ARKのPHドメインがG蛋白質の -ARKのPHドメインがG蛋白質の  サブユニットと結合することからmSos1のPHドメインがG蛋白質からRasへのシグナル伝達に関わっていることが予想された。この可能性を検証するために,mSos1のPHドメイン(アミノ酸残基432-632番)をPC12細胞で過剰発現し,LPA(lysophosphatidic acid)によるRas-MAPK活性化経路(G蛋白質を介する経路)に対する影響を調べた。その結果,mSos1のPHドメインを過剰発現させてもLPAによるMAPK活性化を抑制することができなかったことから,mSos1はG蛋白質からRasへのシグナル伝達経路に関わっていないことが示唆された。また多様なPH domainがPIP2と結合することが見出されているが,SosのPHドメインについての報告は出ていない。そこで,mSos1のPHドメインとPIP2との結合を遠心分離法により測定し、mSos1のPHドメインもPIP2と結合することを明らかにした。 サブユニットと結合することからmSos1のPHドメインがG蛋白質からRasへのシグナル伝達に関わっていることが予想された。この可能性を検証するために,mSos1のPHドメイン(アミノ酸残基432-632番)をPC12細胞で過剰発現し,LPA(lysophosphatidic acid)によるRas-MAPK活性化経路(G蛋白質を介する経路)に対する影響を調べた。その結果,mSos1のPHドメインを過剰発現させてもLPAによるMAPK活性化を抑制することができなかったことから,mSos1はG蛋白質からRasへのシグナル伝達経路に関わっていないことが示唆された。また多様なPH domainがPIP2と結合することが見出されているが,SosのPHドメインについての報告は出ていない。そこで,mSos1のPHドメインとPIP2との結合を遠心分離法により測定し、mSos1のPHドメインもPIP2と結合することを明らかにした。 mSos1のN-末端側領域にあるDHドメインはRho familyのGDP/GTP交換因子であるDb1と相同性はもっているが,機能に関しては明確になっていない。mSos1のDHドメインを含む領域(アミノ酸204-458,GST-DH;アミノ酸204-632,GST-DH-PH)を大腸菌で発現し,Rho family(RhoA,CDC42,Rac1)に対してGDP/GTP交換促進活性活性を調べたが,検出できなかった。GST-DH-PHについてPHドメインとPIP2が結合することから,反応液にPIP2,IP3,IP4などを加えてGDP/GTP交換促進活性を測定したが,検出できなかった。また,DHドメインを含んだN-末端側領域はSosの活性にpositiveな機能をもっていることが報告されている。しかし,本研究で,このN-末端側領域をdeletionしたmSos1が全長のmSos1よりRas-MAPK経路を活性化することからmSos1のN-末端側領域はmSos1の活性を抑制していることが明らかになった。このことはまだ知られていないSosの活性化メカニズムがあることを示唆するものである。 SosとRasとの相互作用にはRasのswitch2領域(アミノ酸残基62-69番)が関わっていることは報告されていたが,Rasの他の領域についてはまだ解析されていなかった。そこで,アミノ酸残基12番から65番までの領域についてのRas変異体に対してmSos1(アミノ酸残基584-1088)のGDP/GTP交換促進活性を測定した。その結果,Ras変異体N26G,E31K,P34H,D38Nに対しては活性が検出できなかった。出芽酵母のScd25については,switch1領域中の幾つかの変異体についてGDP/GTP交換促進活性が低下していることが報告されていたが,本研究で新しく26,31,34番の残基についてもSosとの相互作用に関わっていることが示された。 |
| 審査要旨 | | 癌遺伝子産物Rasは酵母からヒトに至るまで高度に保存されており,細胞の増殖や分化を制御していることが知られている。非刺激下の細胞ではRasは大部分がGDP結合型として細胞膜に結合して存在しており、不活性型であるGDP結合型から活性型であるGTP結合型への転換はGDP/GTP交換反応はGDP/GTP交換因子(GEF)によって促進されることが明らかになっている。GTP結合型からGDP結合型への交換は内在性のGTPase活性によって行われ,この反応を促進するGTPase活性促進蛋白質(GAP)が存在している。Ras GEFとしてはCdc25,Sdc25,Ras-GRF,Sosなどが見出されている。Sosの配列ではCDC25ドメインの外にDH、PH、Proline-richドメインが存在している。 本論文では細胞外signalからRasに至るシグナル伝達機構の解析に向けて、マウスSos1(mSos1)の機能解析を行なっている。 本論文の第2章では、mSos1のCDC25ドメインを含む領域をGST融合蛋白質として大腸菌で発現させた後,精製してH-Rasに対する活性測定を行い、アミノ酸残基584-1088番のみからなる融合蛋白質がHa-Rasに対して充分なGDP/GTP交換促進活性をもっていることを示している。これより小さい,アミノ酸残基618-1088番のみからなる融合蛋白質では、報告されているCDC25ドメイン領域をすべて含んでいるのにも関わらず、GDP/GTP交換促進活性が検出できなかったことからmSos1の活性にはアミノ酸残基584-617番の領域が重要な機能を担っていることを明らかにしている。その領域について,他のCDC25ドメインの一次配列と比較すると,アミノ酸残基584-617番の領域が保存されていないので,この34個のアミノ酸はSosのGDP/GTP交換活性に特異的な役割を担っていると考察している。RasのC末端側にはシステイン残基を含むユニークなアミノ酸配列(CAAX;Cはシステイン,Aは脂肪族アミノ酸;Xは任意のアミノ酸)があり,そのシステイン残基にファルネシル基がファルネシル転移酵素によりチオエーテル結合で結合することが知られている。この脂質の修飾がRasの機能に重要なことは明らかになっているがmSos1が作用する際にもC-末端の修飾がある方がよく作用するということを明らかにしている。Ras-GRFの場合にはRasの修飾の影響がなかったことからCDC25ドメインのアミノ酸の配列差が修飾の認識に関与していることを示唆している。 第3章では,細胞内でのmSos1によるRasの活性化メカニズムを調べるために多様なdeletion mutantをHEK293細胞で発現させMAPKの活性化の程度を測定し、これまでの報告と異なり,CDC25ドメインのみからなるmSos1(アミノ酸残基584-1088番)を発現させることで充分にMAPKが活性化することを明らかにしている。これは細胞内でmSos1のCDC25ドメインのみで充分にGDP/GTP交換因子として働いていることを意味している。実際,MAPKの活性化という点ではPHドメインとCDC25ドメインからなるmSos1(アミノ酸残基429-1088番)はCDC25ドメインのみの蛋白質(アミノ酸残基584-1088番)と同程度であったことからPHドメインはmSos1が細胞内でRas-MAPK経路の活性化に直接には関係していないことを示唆している。Sosを細胞膜につなぐ役割はGrb2結合部位ではなく,PHドメインが担っている可能性が予想されていたが,CDC25ドメインのみの蛋白質(アミノ酸残基584-1088番)が半分以上膜分画に存在していたことから膜への局在にはCDC25ドメインのみでも充分であることを明らかにしている。このことはSosが膜に移動するためにはCDC25ドメインが重要な役割を担っていることを示すものである。また,mSos1のGrb2結合部位を欠失させることによって,Ras-MAPK経路の活性化能が上昇することからmSos1のC-末端側領域は阻害的に働いていることを確認している。 第4章では,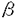 -ARKのPHドメインがG蛋白質の -ARKのPHドメインがG蛋白質の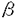 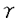 サブユニットと結合することからmSos1のPHドメインがG蛋白質からRasへのシグナル伝達に関わっていることが予想されており、この可能性を検証するために,mSos1のPHドメイン(アミノ酸残基432-632番)をPC12細胞で発現し,LPA(lysophosphatidic acid)によるRas-MAPK活性化経路(G蛋白質を介する経路)に対する影響を調べている。その結果,mSos1のPHドメインを過剰発現させてもLPAによるMAPK活性化を抑制することができなかったことから,mSos1はG蛋白質からRasへのシグナル伝達経路に関わっていないことを示唆している。また多様なPH domainがPIP2と結合することが見出されているが,SosのPHドメインについての報告は出ていない。そこで,mSos1のPHドメインとPIP2との結合を遠心分離法により測定し、mSos1のPHドメインもPIP2と結合することを明らかにしている。mSos1のN-末端側領域にあるDHドメインはRho familyのGDP/GTP交換因子であるDb1と相同性はもっているが,機能に関しては明確になっていない。mSos1のDHドメインを含む領域(アミノ酸204-458,GST-DH;アミノ酸204-632,GST-DH-PH)はRho family(RhoA,CDC42,Rac1)に対してGDP/GTP交換促進活性をもっていないが、mSos1のN-末端側領域はmSos1の活性を抑制していることを明らかにしている。 サブユニットと結合することからmSos1のPHドメインがG蛋白質からRasへのシグナル伝達に関わっていることが予想されており、この可能性を検証するために,mSos1のPHドメイン(アミノ酸残基432-632番)をPC12細胞で発現し,LPA(lysophosphatidic acid)によるRas-MAPK活性化経路(G蛋白質を介する経路)に対する影響を調べている。その結果,mSos1のPHドメインを過剰発現させてもLPAによるMAPK活性化を抑制することができなかったことから,mSos1はG蛋白質からRasへのシグナル伝達経路に関わっていないことを示唆している。また多様なPH domainがPIP2と結合することが見出されているが,SosのPHドメインについての報告は出ていない。そこで,mSos1のPHドメインとPIP2との結合を遠心分離法により測定し、mSos1のPHドメインもPIP2と結合することを明らかにしている。mSos1のN-末端側領域にあるDHドメインはRho familyのGDP/GTP交換因子であるDb1と相同性はもっているが,機能に関しては明確になっていない。mSos1のDHドメインを含む領域(アミノ酸204-458,GST-DH;アミノ酸204-632,GST-DH-PH)はRho family(RhoA,CDC42,Rac1)に対してGDP/GTP交換促進活性をもっていないが、mSos1のN-末端側領域はmSos1の活性を抑制していることを明らかにしている。 第5章では、Ras変異体に対してmSos1(アミノ酸残基584-1088番)のGDP/GTP交換促進活性の測定を行い、新しく26,31,34番の残基についてもmSos1との相互作用に関わっていることを示唆している。 以上の研究において、mSos1のドメイン変異体の作成および精製、HEK293細胞における解析、GDP/GTP交換促進活性活性測定などの生化学的な解析、PHドメインとPIP2との結合の遠心分離法による測定など、すべて論文提出者が行い博士(理学)の学位を受ける資格あるものと判定した。なお、本論文は、東京大学の横山茂之教授、理化学研究所の白水美香子博士、神戸大学の片岡徹教授、Peter MacCallum癌研究所のDavid Bowtell博士との共同研究であるが、論文提出者が主体となって分析及び検証を行ったもので、論文提出者の寄与が十分であると判断した。 |