Prostaglandin E2(PGE2)はマクロファージなどの抗原提示細胞によるアラキドン酸代謝の主要な産生物である。これは免疫系細胞に対して種々の作用を持ち、T細胞の増殖やIL-2産生、IL-2レセプター発現を抑制するが、IL-4、IL-5産生は抑制せず、また、IL-4によって制御されるB細胞の免疫グロブリン遺伝子のクラススイッチやIgE産生を増強することが報告されている。PGE2はそのレセプターに共役しているG proteinを介してadenylate cyclaseを活性化し、細胞内cAMPレベルを上昇させる。また、dibutyryl cAMP(dBcAMP)は細胞膜を透過し細胞内でcAMPと同様の効果を持つ。これらの薬剤による細胞内cAMPレベルの上昇によってcAMP依存性protein kinase(PKA)が活性化され、種々のT細胞機能に影響を及ぼすと考えられる。これらによって、T細胞内のいくつかのシグナル分子や転写因子の活性が抑制されることが既に報告され、cAMPの作用機序についての知見が得られつつある。このように、cAMPのT細胞内における作用機序について解析することは、免疫反応や炎症におけるリンパ球の機能やT細胞内シグナル伝達経路について理解を深める上で重要である。 T細胞レセプター(TCR)を介するシグナル伝達はTCR/CD3複合体とそれに会合するZAP70やFynなどのtyrosine kinase、ShcやGrb2などのadaptor proteinから開始する。これらによって活性化されたphospholipase C-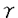 1(PLC- 1(PLC-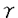 1)はphosphatidylinositol bisphosphateをdiacylglycerolとinositol triphosphateに加水分解する。前者はprotein kinase C(PKC)を活性化し、後者はCa2+の細胞内流入を誘導する。PKCはRasを介してMEKKやRafを活性化し、MEK活性化を経て、MAP kinase(MAPK)の活性化に至る。細胞内Ca2+レベルの上昇はCa2+/calmodulin-dependent kinase/phosphataseを活性化するが、そのphosphataseの一つであるcalcineurinはIL-2やIL-4などのサイトカイン産生に関わる転写因子NF-ATを脱リン酸化することによって核内へ移行させる。これは核内でAP-1と複合体を形成し、種々のサイトカイン産生を制御する。 1)はphosphatidylinositol bisphosphateをdiacylglycerolとinositol triphosphateに加水分解する。前者はprotein kinase C(PKC)を活性化し、後者はCa2+の細胞内流入を誘導する。PKCはRasを介してMEKKやRafを活性化し、MEK活性化を経て、MAP kinase(MAPK)の活性化に至る。細胞内Ca2+レベルの上昇はCa2+/calmodulin-dependent kinase/phosphataseを活性化するが、そのphosphataseの一つであるcalcineurinはIL-2やIL-4などのサイトカイン産生に関わる転写因子NF-ATを脱リン酸化することによって核内へ移行させる。これは核内でAP-1と複合体を形成し、種々のサイトカイン産生を制御する。 AP-1はFosおよびJunファミリーのダイマーから成る。その一員であるc-Fosやc-Junの発現及び活性誘導はMAPKファミリーのextracellular signal-regulated kinase2(ERK2)やc-Jun N-terminal kinase(JNK)によって制御されている。ERK2、JNK共に種々の刺激によって活性化されるが、T細胞では抗CD3抗体やphorbol myristate acetate(PMA)/calcium ionophoreによる刺激で活性化される。ERK2はElk-1を介してc-Fosの発現誘導に関与している。また、JNKはc-Junの特異的なセリン残基(Ser-63,73)をリン酸化することによってその転写活性を誘導している。したがって、TCRシグナルにおいて、MAPKは重要な役割をはたしており、これらの機能解析はT細胞内シグナル伝達のメカニズムを知る上で重要な課題の一つになっている。 申請者はPGE2やdBcAMPなどの細胞内cAMPレベルを上昇させる薬剤に注目し、IL-2産生に関わる転写因子NF-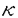 B,NF-AT,AP-1のDNA結合や、AP-1の構成成分であるc-Fos、c-Junの発現及び活性を調節しているMAPKの活性に対する効果を解析することによって、TCRシグナルに対するcAMPの作用機序を明らかにすることを本研究の目的とした。 B,NF-AT,AP-1のDNA結合や、AP-1の構成成分であるc-Fos、c-Junの発現及び活性を調節しているMAPKの活性に対する効果を解析することによって、TCRシグナルに対するcAMPの作用機序を明らかにすることを本研究の目的とした。 IL-2は抗原提示されたヘルパーT細胞によって産生され、T細胞の増殖を誘導する作用を持つ。すなわち、IL-2はin vivoの免疫反応において重要な役割をはたしているといえる。ここではヒトT細胞クローンSP-B21(Th0)によるIL-2産生に対するPGE2の効果をRT-PCRで解析した。PMA/A23187刺激によって誘導されるIL-2産生はPGE2によって抑制された。PKCやCa2+の上流に存在するPLC-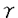 1の活性をcAMPが抑制することは既に報告されているが、ここで観察された結果から、PKC/Ca2+の上流だけでなく、下流にもcAMPによって制御されるシグナル分子が存在することが推察される。 1の活性をcAMPが抑制することは既に報告されているが、ここで観察された結果から、PKC/Ca2+の上流だけでなく、下流にもcAMPによって制御されるシグナル分子が存在することが推察される。 次に、T細胞においてIL-2産生に関わる転写因子NF- B、NF-AT、AP-1のDNA結合活性に対するcAMPの効果を解析した。NF- B、NF-AT、AP-1のDNA結合活性に対するcAMPの効果を解析した。NF- BのDNA結合活性は抗CD3抗体刺激時にはPGE2やdBcAMPによって抑制されたが、PMA/A23187刺激時には抑制されなかった。また、NF-ATやAP-1のDNA結合活性はどちらの刺激でもPGE2によって抑制されなかった。これらの結果から、PMA/A23187刺激によって誘導されるIL-2産生のcAMPによる抑制効果はNF-ATやAP-1のDNA結合活性とは異なる機序によるものであることが推察される。 BのDNA結合活性は抗CD3抗体刺激時にはPGE2やdBcAMPによって抑制されたが、PMA/A23187刺激時には抑制されなかった。また、NF-ATやAP-1のDNA結合活性はどちらの刺激でもPGE2によって抑制されなかった。これらの結果から、PMA/A23187刺激によって誘導されるIL-2産生のcAMPによる抑制効果はNF-ATやAP-1のDNA結合活性とは異なる機序によるものであることが推察される。 AP-1の構成因子の一つであるc-Junの転写活性はその特異的部位のリン酸化によって誘導されている。次に、c-JunのSer-63リン酸化に対するdBcAMPの効果をウェスタンブロットで解析した。PMA/A23187刺激によって誘導されるこのリン酸化はdBcAMPによるT細胞の前処理によって抑制された。したがって、cAMPによるIL-2の産生抑制はc-JunのSer-63リン酸化の抑制によっておこることが示唆される。 AP-1を構成するFos/Junファミリーの発現及び活性はMAPK(ERK2、JNK)によって制御されている。したがって、cAMPのAP-1活性に対する効果はMAPKに対する作用の結果であることが推測される。c-Junリン酸化に対するcAMPの作用機序を明らかにするために、ヘルパーT細胞のERK2およびJNKの各アイソフォームのキナーゼ活性に対するdBcAMPの効果を解析した。JNKにはJNK1、JNK2、JNK3の3種類のアイソフォームの存在が知られている。これらの基質としてc-Jun、ATF-2、Elk-1の3種類が見い出されている。しかし、アイソフォーム間の機能や基質特異性に何らかの差異があるかどうかは明らかではない。 まず、ERK2のキナーゼ活性をwestern blotおよびin vitro kinase assayで解析した。ERK2活性化はPMA単独またはPMA/A23187刺激によって誘導された。このキナーゼ活性に対するdBcAMPの効果は見られなかった。 次に、JNKのキナーゼ活性に対するdBcAMPの効果をin vitro kinase assayおよびin-gel kinase assayで解析した。前者ではそれぞれのアイソフォームに特異的な抗体で免疫沈降した蛋白質の活性を測定し、後者ではSDS-PAGEでそれぞれのアイソフォーム分離してゲル内で反応させた。したがって、これらのアッセイにより、JNK1、JNK2の活性を独立して観察することができる。 JNK1、JNK2共にPMAとA23187の両者による刺激によって活性化された。dBcAMP添加によってJNK2のキナーゼ活性は抑制されたが、JNK1のキナーゼ活性は抑制されなかった。SP-B21だけではなく、Th1クローンであるTA23でも同様の結果が得られた。 これらの結果から、ヒトヘルパーT細胞においてc-Fos、c-Junの発現や活性化を誘導しているMAPKのうち、cAMPによってキナーゼ活性が抑制されるのはERK2やJNK1ではなくJNK2であることが明らかになった。これにより、cAMPによるJNK2活性抑制がc-Junの転写活性の抑制、ひいてはIL-2産生の抑制につながっていることが示唆された。更に、c-JunのSer-63リン酸化とJNK2活性に対するcAMPの作用が同一であったことから、in vivoにおけるc-Junリン酸化は主にJNK2によって制御されており、JNK1はこれにさほど関与していないことが推察された。JNK2はJNK1よりもc-Junに対する結合能が高いという報告はこの推測を裏付けるものである。また、JNK1はin vivoにおいてc-Junリン酸化以外の未知の機能を有していることが推測される。 |