学位論文要旨
| No | 113105 | |
| 著者(漢字) | 厚味,厳一 | |
| 著者(英字) | ||
| 著者(カナ) | アツミ,ゲンイチ | |
| 標題(和) | アポトーシス細胞におけるグリセロリン脂質脱アシル化・再アシル化酵素群の解析 | |
| 標題(洋) | ||
| 報告番号 | 113105 | |
| 報告番号 | 甲13105 | |
| 学位授与日 | 1998.03.11 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 博薬第814号 | |
| 研究科 | 薬学系研究科 | |
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | アポトーシスと呼ばれる細胞死は細胞への特定の刺激により誘導され、細胞小体の形成や核の凝集など細胞構造の大きな変化を伴うことから、生体膜構造の大きな変化が予想されるが、その生化学的な解析はほとんど行なわれていない。本研究ではアポトーシスに伴うグリセロリン脂質の変化及びそれに関わる代謝酵素群の変動について解析した。 放射標識アラキドン酸であらかじめ標識したヒト単核球系白血病細胞株U937細胞に抗Fas抗体処理でアポトーシスを誘導したところ、放射標識アラキドン酸含有ホスファチジルコリン及びホスファチジルエタノールアミンが有意に減少し、遊離アラキドン酸が有意に増加した。この遊離アラキドン酸の増加は抗Fas抗体処理時間および量依存的であり、アポトーシスの進行に相関していた。同様の実験を、放射標識グリセロールあるいは正リン酸であらかじめ標識した細胞を用いて行ったところ、アポトーシス誘導によるグリセロリン脂質組成に有意な差は観察されず、リゾリン脂質の蓄積もなかった。以上の結果は、(1)アポトーシスに伴いグリセロリン脂質の脱アシル化反応が亢進していること、(2)脱アシル化により生成したリゾリン脂質は再アシル化されグリセロリン脂質に戻ることを示唆している。 生体膜主要構成成分であるグリセロリン脂質2位のエステル結合を加水分解する酵素であるホスホリパーゼA2(PLA2)は現在までに約10種類以上のサブタイプが同定されている。その中で、様々な細胞や臓器に普遍的に存在する細胞質ホスホリパーゼA2(cPLA2)はアラキドン酸含有リン脂質に選択的に作用し、刺激に呼応した細胞内カルシウム濃度上昇などにより活性化され細胞膜へ移行することから、アラキドン酸代謝開始に重要な役割を担うと考えられている。 アポトーシスに伴う脱アシル化反応にcPLA2が関与する可能性を想定し解析したしかし、U937細胞中のcPLA2活性は予想に反し、抗Fas抗体量依存的に減少した。また、アポトーシス細胞中のcPLA2タンパクを抗ヒトcPLA2ポリクローナル抗体を用いたウエスタンブロッティングにより調べたところ、みかけの分子量が110kDaのインタクトなcPLA2が消失し、78kDaのタンパクが出現した。この現象はアポトーシスの進行(死細胞率の増加およびDNAの断片化)に相関していた。また、抗ガン剤であるエトポシドによりU937細胞にアポトーシスを誘導した場合、あるいはヒト前骨髄急性白血病細胞株HL60細胞に抗Fas抗体またはエトポシド処理でアポトーシスを誘導した場合にも同様の現象が観察された。 in vitro transcription/translation法で[35S]Met標識cPLA2を作製し、抗Fas抗体処理でアポトーシスを誘導したU937細胞のライセートと反応させた。その結果[35S]cPLA2のインタクトなバンドは細胞のライセート量あるいは反応時間依存的に減少し、78kDaタンパクが生成した(図1、左2列)。この変換はアポトーシスを誘導していない細胞のライセートでは観察されなかったことから、アポトーシスによりcPLA2を限定分解するプロテアーゼ活性が細胞に誘導されることが示唆された。  アポトーシスの進行に伴いCaspase Familyプロテアーゼが活性化される。[35S]Met標識cPLA2を用いた限定分解検出系で種々検討した結果、Caspas-3阻害剤が本反応を抑制した。そこで、細胞ライセート中のCaspase-3活性を測定したところ、抗Fas抗体処理3時間後より時間依存的に上昇し、cPLA2限定分解の経時変化とよく相関していた。さらに、cPLA2の522番目のアスパラギン酸周辺のアミノ酸配列に、これまで報告のあるCaspase-3が認識するコンセンサス配列のDXXDサイトが存在することに着目し、522番目のアスパラギン酸をアスパラギンに変えたcPLA2(D522N)を作製し、この変異cPLA2がアポトーシスを誘導したU937細胞ライセートにより、限定分解されるか否かを調べた。その結果、変異cPLA2は限定分解されなかった(図1、右2列)。また、523番目を終止コドンにかえたcPLA2(1-522)を作製したところ、アポトーシスにより観察される78kDaのcPLA2限定分解産物と同じ位置に泳動された。また、cPLA2(1-522)を細胞に発現させたところcPLA2活性は発現前と差が見られなかった。以上の結果よりcPLA2上の522番目のアスパラギン酸がFas依存的なアポトーシスに伴い活性化されるCaspase-3による分解部位であると結論した。また、興味深いことにcPLA2(1-522)は細胞質画分ではなく膜画分にすべて回収された。 ヒト胎児腎細胞株293細胞における内在性cPLA2の発現は検出限界以下であった。この細胞にインタクトなcPLA2あるいはcPLA2(D522N)の遺伝子を導入し、恒常的に発現した細胞株を樹立した。これらの細胞の成長に有意な差は見られなかった インタクトなcPLA2とcPLA2(D522N)の細胞活性化に伴うアラキドン酸遊離反応の差異を調べた。その結果、インタクトなcPLA2が発現した細胞では予想通りカルシウムイオノフォアによる即時的刺激、またはIL-1と血清刺激による遅発的刺激の両者で有意なアラキドン酸遊離増強効果が観察されたが、cPLA2(D522N)を発現した細胞ではどちらの刺激においてもアラキドン酸遊離は親株と差がなかった。しかし、cPLA2(D522N)発現細胞のライセート中のcPLA2活性は親株と較べて有意に増加していた。この結果から、cPLA2のAsp522はアラキトン酸代謝過程でのcPLA2機能発現に重要な役割を担うことを示唆している。 (1)に示したようにアポトーシス細胞ではリゾリン脂質に再びアシル基が付加し、リン脂質に戻る再アシル化反応が亢進していると予想された(図2A)。実際、再アシル化酵素の1つであるアシルCoAリゾホスファチジルコリンアシルトランスフェラーゼ活性を測定したところ、アポトーシス細胞では比活性が約3倍上昇していた。 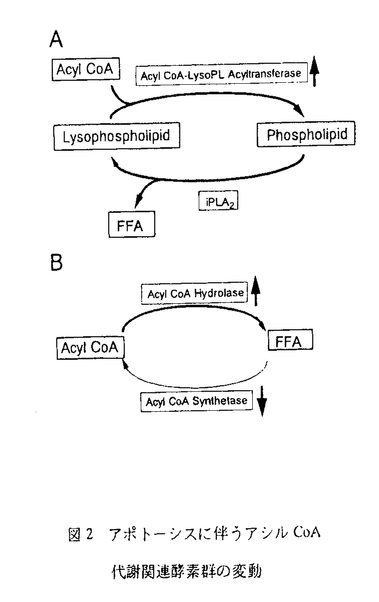 (1)に示したようにアポトーシス細胞ではグリセロリン脂質の脱アシル化反応が亢進していることから、本反応に既知のPLA2アイソザイムが関与することを想定し、阻害剤の効果を検討したところ、カルシウム非依存性PLA2の阻害剤で抑制された。しかし、(2)に示すcPLA2を始め、既知のカルシウム依存性PLA2の阻害剤は全く効果がなかった。また、PLA2によらないアラキドン酸遊離経路として、図2Bに示すアシルCoA加水分解酵素に注目した。その結果、アポトーシス細胞では比活性が約2倍上昇しており、Acyl CoAの加水分解が亢進していた。また、逆反応であるアシルCoA合成酵素活性は、アポトーシス細胞では比活性が約4分の1に減少したことより、アポトーシスに伴いこの平衡反応は大きく右に傾いていることがわかった。 ILA型sPLA2は正常状態にある細胞の膜には作用できないが、活性化された細胞の膜には作用できることが明らかにされている。そこで、アポトーシスに伴う細胞膜構造の変化によりILA型sPLA2感受性となるかを検討した。神経様に神経成長因子(NGF)により分化させたPC12細胞からNGFを除去することによりアポトーシスを誘導した。PC12細胞をあらかじめ放射標識アラキドン酸で標識しておくと、アポトーシスに伴うアラキドン酸の遊離が観察される。さらに、ILA型sPLA2を共存させるとこのアラキドン酸遊離は著しく増加し、アポトーシス細胞がILA型sPLA2に感受性となった。U937細胞に抗Fas抗体でアポトーシスを誘導した場合にも、この増強効果は観察された。この増強効果は、ILA型sPLA2の細胞への作用に必須と考えられていたヘパリンへの結合は必要とせず、酵素活性が必要であった。アポトーシス細胞が生体内でILA型sPLA2の標的細胞となる可能性が示唆された。 アポトーシス細胞で、グリセロリン脂質の脱アシル化および再アシル化反応、いわゆるリモデリング系が亢進していることが示唆された。酵素レベルの解析の結果、(1)アシルCoAレベルの低下、(2)アシルCoAリゾリン脂質アシル基転移酵素活性の亢進を明らかにした。今後は、これらのことがアポトーシス細胞におけるアポトーシス小体形成や細胞膜断片化などの急激な細胞膜構造の変化に対応した細胞膜構造を保つ過程の一つと想定し、解析する予定である。 抗Fas抗体で誘導されたアポトーシスに伴うCaspase-3活性化によるcPLA2の522番目の残基での限定分解により、活性発現に必要とされるアミノ酸残基の一つ(Asp549)が取り除かれる。このため酵素活性が消失すると考えられる。さらに、この限定分解部位周辺は、(1)活性化に伴う膜移行の調節、(2)刺激に呼応したアラキドン酸代謝、で共に重要な役割を持つと予想された。 | |
| 審査要旨 | アポトーシスと呼ばれる細胞死は細胞への特定の刺激により誘導され、細胞小体の形成や核の凝集など細胞構造の大きな変化を伴うことから、生体膜構造の大きな変化が予想されるが、その生化学的な解析はほとんど行なわれていない。本研究はアポトーシスに伴うグリセロリン脂質の変化及びそれに関わる代謝酵素群の変動について解析したものである。 放射標識アラキドン酸であらかじめ標識したヒト単核球系白血病細胞株U937細胞に抗Fas抗体処理でアポトーシスを誘導したところ、放射標識アラキドン酸含有ホスファチジルコリン及びホスファチジルエタノールアミンが有意に減少し、遊離放射標識アラキドン酸が有意に増加した。放射オレイン酸標識した細胞でもアポトーシスに伴うオレイン酸遊離が観察された。阻害剤を用いた検討などからこのアポトーシスに伴う脱アシル化反応への、iPLA2の関与が示唆された。一方、同様の実験を放射標識グリセロールあるいは正リン酸で標識した細胞を用いて行ったところ、アポトーシス誘導によるグリセロリン脂質組成に有意な差は観察されず、リゾリン脂質の蓄積もなかった。アポトーシス細胞ではリゾリン脂質に再びアシル基が付加しリン脂質に戻る再アシル化反応が亢進していると予想された。実際、再アシル化酵素の1つであるアシルCoAリゾホスファチジルコリンアシルトランスフェラーゼ活性を測定したところ、比活性が約3倍上昇していた。アポトーシスに伴いグリセロリン脂質の脱アシル化・再アシル化反応が亢進していることが示された。 アポトーシス細胞で観察された、遊離脂肪酸生成の亢進のメカニズム解明をめざした。アシルCoA加水分解酵素の比活性がアポトーシス細胞では約2倍上昇していた。また、逆反応であるアシルCoA合成酵素活性は、アポトーシス細胞では比活性が約4分の1に減少したことにより、アポトーシスに伴いこの平衡反応が脂肪酸遊離側に大きく傾いていることがわかった。 アポトーシス細胞中のcPLA2タンパクをウェスタンブロッティングにより調べたところ、みかけの分子量が110kDaのインタクトなcPLA2が消失し、78kDaのタンパクが出現した。この現象はアポトーシスの進行(死細胞率の増加およびDNAの断片化)に相関していた。さらに、in vitro transcription/translation法で[35S]Met標識cPLA2を作製し、抗Fas抗体処理でアポトーシスを誘導したU937細胞のライセートと反応させた結果、[35S]cPLA2のインタクトなバンドは減少し、78kDaタンパクが生成した。この変換はアポトーシスを誘導していない細胞のライセートでは観察されなかったことから、アポトーシスによりcPLA2限定分解するプロテアーゼ活性が細胞に誘導されることが示唆された。さらに、(1)Caspas-3阻害剤が本反応を抑制すること、(2)細胞ライセート中のCaspas-3活性は、cPLA2限定分解の経時変化とよく相関すること、(3)Caspas-3が認識するコンセンサス配列と予想された522番目のアスパラギン酸をアスパラギンに変えたcPLA2(D522N)がアポトーシスを誘導したU937細胞ライセートにより限定分解されなかったこと、(4)523番目を終止コドンにかえたcPLA2(1-522)を作製したところ、アポトーシスにより観察される78kDaのcPLA2限定分解産物と同じ位置に泳動されたことを観察した。以上より、cPLA2上の522番目のアスパラギン酸がFas依存的なアポトーシスに伴い活性化されるCaspas-3による分解部位であると結論した。 以上、本研究はアポトーシス細胞における膜脂質代謝の変動を解析したもので、アポトーシス小体形成や細胞膜断片化などの急激な細胞膜構造の変化のメカニズム解明につながる可能性があり、博士(薬学)の学位に値すると判定した。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54607 |