| 内容要旨 | | 活性酸素・フリーラジカルによる生体膜の酸化傷害の蓄積が,癌や糖尿病などを含む種々の疾病や老化に関与していると考えられている.しかし,生体膜の酸化初期の詳細な解明は不十分である.本論文では,酸化され易い高度不飽和脂肪酸を含むリン脂質の酸化に注目した.図1に示すように,フリーラジカルにより,リン脂質はラジカル連鎖的に酸化され,第一酸化生成物としてリン脂質ヒドロペルオキシドを与える.これに対して,生体中にはスーパーオキシドディスムターゼのような予防的坑酸化剤やビタミンE(VE)のような連鎖停止型坑酸化剤が存在し,酸化傷害から生体を守っていると考えられる.また,生成したリン脂質ヒドロペルオキシドも,ホスホリパーゼやペルオキシダーゼのような酵素により加水分解や還元を受けて除去されるものと考えられる.ここで述べた坑酸化剤や坑酸化酵素の研究は,個々のものに関してはこれまで多くの研究者のよりなされてきたが,一つの系で多くのものを扱った報告は少なく,生体膜の酸化時に起きていることが全体像として見えていない.そこで,本研究では,このことを明らかにすることを一つの目的した. 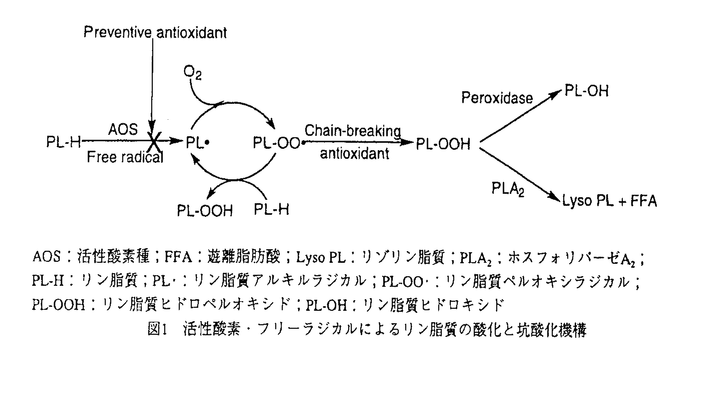 図1 活性酸素・フリーラジカルによるリン脂質の酸化と坑酸化機構AOS:活性酸素種;FFA:遊離脂肪酸;Lyso PL:リゾリン脂質;PLA2:ホスフォリパーゼA2;PL-H:リン脂質;PL・:リン脂質アルキルラジカル;PL-OO・:リン脂質ペルオキシラジカル;PL-OOH:リン脂質ヒドロペルオキシド;PL-OH:リン脂質ヒドロキシド 図1 活性酸素・フリーラジカルによるリン脂質の酸化と坑酸化機構AOS:活性酸素種;FFA:遊離脂肪酸;Lyso PL:リゾリン脂質;PLA2:ホスフォリパーゼA2;PL-H:リン脂質;PL・:リン脂質アルキルラジカル;PL-OO・:リン脂質ペルオキシラジカル;PL-OOH:リン脂質ヒドロペルオキシド;PL-OH:リン脂質ヒドロキシド 近年,フリーラジカルの細胞内情報伝達機構への関与を示す報告が為されるようになった.しかし,これらの報告は,細胞にフリーラジカルを作用させて,ある結果が得られたというものであり,その過程についての報告がほとんど無く,フリーラジカルによる細胞内情報伝達機構のメカニズムについては分かっていない.そこで,リン脂質が酸化された時に生成し得るジアシルグリセロール酸化生成物が,フリーラジカルによる生体膜の酸化を,細胞内情報伝達に変換するセカンドメッセンジャーとして働くことを予想し,ジアシルグリセロール酸化生成物によるプロテインキナーゼCの活性化について明らかにすることを本論文の2つめの目的とした。 初めに行ったことは,ラット肝臓脂質を異なる反応場で酸化させた時の生成物の違いを比較し,生体膜酸化時に何が起きているのかを検討した.脂質を有機溶媒中に抽出した溶液(A,C)と,これから多重膜リポソーム膜(B,D)を調製し,脂溶性ラジカル開始剤であるAMVN(5mM)を用い,37度大気下において酸化を行った結果を図2に示す.溶液中でラット肝臓リン脂質の酸化反応を行った場合,VE消失後に酸化生成物としてホスファチジルコリンヒドロペルオキシド(PC-OOH)とホスファチジルエタノールアミンヒドロペルオキシド(PE-OOH)の生成のみが認められた(図2A).リポソームの酸化においてもPC-OOHとPE-OOHのみの生成が認められた(図2B).一方,細胞内オルガネラの混合物であるホモジネートを20mM AMVNを用いて酸化させた場合,PC-OOHとPE-OOH以外にそれらの還元体であるPC-OHとPE-OHの生成が認められ,ペルオキシダーゼの関与が示唆された(図3).また,脂肪酸ヒドロキシドの生成も認められ(Result not shown),ホスホリパーゼA2(PLA2)の重要性も示唆された.以上の結果から,生体中でリン脂質の酸化が起こったときには,坑酸化剤の防御が有り,かつ,PLA2やペルオキシダーゼ等の坑酸化酵素が2次的に酸化傷害に対して生体を防御していることが示唆された.  図2 溶液中(A,C)及びリポソーム膜中(C,D)におけるラット肝臓リン脂質のAMVNによる酸化 図2 溶液中(A,C)及びリポソーム膜中(C,D)におけるラット肝臓リン脂質のAMVNによる酸化 図3 ラット肝臓ホモジネートのAMVNによる酸化 図3 ラット肝臓ホモジネートのAMVNによる酸化 次に,ジアシルグリセロール(DAG)ヒドロペルオキシド(DAG-OOH)やDAGヒドロキシド(DAG-OH)のラット脳粗精製プロテインキナーゼC(PKC)活性化能について検討した.カルシウムイオンとホスファチジルセリン存在下において,DAG-OOHやDAG-OHは,時間依存的(Result not shown)にかつ濃度依存的にPKCを活性化した(図4).この活性化は,DAGやPKC活性化に汎用されているジオレイン(DOG)による活性化よりも遥に強力なもので,最も強力なPKC活性化剤の一つであるPMAと同等のものであった.ここには結果は示さないが,カルシウムイオンやホスファチジルセリン非存在下においてもDAG-O(O)Hは,PKCを活性化した.しかし,この結果は,細胞外に取りだしたPKCに対する結果であるため,実際に細胞内で働いているPKCに対する活性化能について検討する必要がある.そこで,人好中球をサンプルとして用いた.人好中球はPKCの活性化を通して,スーパーオキシドアニオンを生成することが分かっている.そこで,化学発光試薬であるMCLAを使用し,このスーパーオキシドの産生を化学発光に変換させ,評価した.1-パルミトイル-2-リノレオイル-グリセロールヒドロペルオキシド(PLG-OOH)は,PLGやPLG-OHよりも好中球を活性化することが分かった(図5).この活性化は,ジアシルグリセロールの1位と3位に脂肪酸のついたヒドロペルオキシド(図5)を含む他の物質のヒドロペルオキシド(Result not shown)では認められなかったため,ヒドロペルオキシドで有ることが関係しているのではないことが分かった.さらに,PKCの阻害剤を用いるとPLG-OOHによる好中球の活性化が抑制されたため,確かにPLG-OOHが,人好中球内のPKCを活性化していることが分かった.以上のことから,ジアシルグリセロール酸化生成物は生体膜脂質の酸化を細胞内情報伝達に変換するセカンドメッセンジャーとして働き,これが活性酸素・フリーラジカルと種々の疾病を結び付ける鍵と成り得る重要な物質であることが示唆された.  図4 カルシウムイオン及びホスファチジルセリン存在下における各種活性化剤によるラット脳粗精製PKCの活性化 図4 カルシウムイオン及びホスファチジルセリン存在下における各種活性化剤によるラット脳粗精製PKCの活性化 図5 MCLAを用いた化学発光法で評価した各種刺激剤による人末梢血好中球の活性化能MLI:Maximum Luminescence Intensity 図5 MCLAを用いた化学発光法で評価した各種刺激剤による人末梢血好中球の活性化能MLI:Maximum Luminescence Intensity 異なる反応場におけるラット肝臓リン脂質酸化の結果から得られたように,PLA2が修復酵素として機能しているのであるならば,未酸化のリン脂質より酸化生成物のほうを選択的に加水分解することが重要である.そこで,未酸化の1-パルミトイル-2-リノレオイル-ホスファチジルコリン(PLPC)とPLPC-OOHを用いて1枚膜リポソームを調製し,PLA2を作用させ生成物(リノール酸,18:2や18:2-OOH)と基質の減少を追跡した.しかし,PLA2はPLPCとPLPC-OOHを基質として区別しなかった(Result not shown).しかし,リポソーム膜にコレステロールを取り込ませてやるとコレステロールの濃度に依存して,PLA2はPLPC-OOHのほうを好んで加水分解するようになった(図6).同様の結果がPLPC-OHを用いた場合にも認められた(Result not shown).コレステロールが膜中に入ると膜が硬くなり,未酸化の脂肪酸より水溶性である脂肪酸ヒドロ(ペルオ)キシドが,より膜表面に押し出され,PLA2と接触しやすくなるためだと考えられた.生体膜はリポソーム膜より硬く,脂質の動きが制限されているため,ホスホリパーゼA2がより酸化生成物を好んで加水分解することが考えられる.  図6 PLA2によるPLPC(-OOH)リポソーム膜の加水分解に対するコレステロールの影響 図6 PLA2によるPLPC(-OOH)リポソーム膜の加水分解に対するコレステロールの影響 最後に,生体膜の酸化を細胞内情報に変換すると予想されるジアシルグリセロール酸化生成物の生成経路について検討した.PLPCとPLPC-OOHからなるリポソーム膜にホスホリパーゼC(PLC)を作用させると,PLGの他にPLG-OOHが生成することが分かった(図7).また,結果は示さないが,リポソーム膜中にあるPLG-OOHをリン脂質ヒドロペルオキシドグルタチオンペルオキシダーゼが還元できることも初めて示した.  図7 PLCによるPLPC(-OOH)リポソーム膜加水分解の経時変化結語 図7 PLCによるPLPC(-OOH)リポソーム膜加水分解の経時変化結語 1.ラット肝臓ホモジネートを酸化した場合,リン脂質ヒドロペルオキシド以外にリン脂質ヒドロキシドや脂肪酸ヒドロキシドの生成が認められ,生体膜の酸化傷害に対して還元酵素や加水分解酵素が修復機構の一つとして作用することが示唆された. 2.ジアシルグリセロール酸化生成物はジアシルグリセロールよりもラット脳粗精製プロテインキナーゼCを活性化し,更に人好中球内のプロテインキナーゼCを活性化させた。このことから,ジアシルグリセロール酸化生成物が酸化ストレスに対する細胞内情報伝達物質として機能している可能性が示唆された. 3.コレステロールを加え膜を硬くした場合,ホスホリパーゼA2はホスファチジルコリン酸化生成物をホスファチジルコリンよりも選択的に加水分解し,生体中で坑酸化酵素として重要な役割を担っていることが示唆された. 4.ホスホリパーゼCがリポソーム膜中のホスファチジルコリン酸化生成物を加水分解し,ジアシルグリセロール酸化生成物を与え,リン脂質ヒドロペルオキシドグルタチオンペルオキシダーゼがリポソーム膜中のジアシルグリセロールヒドロペルオキシドを還元することを示した.少なくともこの経路でジアシルグリセロール酸化生成物が生成することが示唆された. |
| 審査要旨 | | 本論文は,活性酸素・フリーラジカルによる生体膜の酸化とこれにより生成するリン脂質酸化生成物の加水分解反応,さらには加水分解生成物の生理活性物質としての働きについて知見を得ることを目的としている. 第1章では,今までに報告されている活性酸素種・フリーラジカルによる脂質の酸化及びそれに対する抗酸化機構,活性酸素種と細胞内情報伝達機構の関わりについて概説し,本研究の意義及び目的を明らかにしている. 第2章では,ラット肝臓リン脂質の酸化に対する反応場の影響を論じている.リン脂質を溶液中や人工膜中で酸化するとリン脂質ヒドロペルオキシドの生成が認められたが,ホモジネートとして酸化するとリン脂質ヒドロペルオキシド以外に,リン脂質ヒドロキシドや脂肪酸ヒドロキシドが認められた.これはラット肝臓中に存在するペルオキシダーゼやホスホリパーゼA2が,生体膜の酸化傷害に対する修復機構として重要な役割を果たしていることを示唆するしている. 第3章では,酸化されたリン脂質がホスホリパーゼCにより加水分解されて生成すると考えられる,ジアシルグリセロールの酸化物によるプロテインキナーゼCの活性化について検討している.この活性化は,未酸化のジアシルグリセロールによる活性化より大きく,最も強力なプロテインキナーゼCの活性化剤の一つであるホルボールエステルによるそれと同等のものであり,興味深い新しい生理活性物質と考えている. 第4章では,細胞内でのジアシルグリセロール酸化生成物の役割を明らかにするためにヒト好中球が用いられている.ジグリセロールヒドロペルオキシドは好中球を活性化し,スーパーオキシドが産生したが,未酸化のジアシルグリセロールには好中球活性化能が認められていない.プロテインキナーゼCの阻害剤はスーパーオキシド産生を抑制したことから,ジアシルグリセロールヒドロペルオキシドが,好中球内のプロテインキナーゼCを活性化して,スーパーオキシドを産生させていることが証明されている.したがって,ジアシルグリセロールヒドロペルオキシドは細胞内情報伝達物質として作用出来ることが実証されている. 第5章では,ホスホリパーゼA2による酸化された人工膜の加水分解反応を定量的に検討している.ホスホリパーゼA2はコレステロールを含むリポソーム膜中の,酸化されたホスファチジルコリンを未酸化のホスファチジルコリンよりもより選択的に加水分解することを初めて明らかにしている.コレステロールを除くとこの選択性はなくなることから,コレステロールは膜中の酸化されたホスファチジルコリンを膜表面に押し出し,ホスホリパーゼA2に加水分解されやすくすると考えられている.実際の生体膜中の脂質はこの人工膜よりさらに動きが制限されているため,ホスホリパーゼA2が生体中では抗酸化酵素として重要な役割を果たしていると推定している. 第6章では,リポソーム膜中の酸化されたリン脂質のホスフォリパーゼCによる加水分解の結果ジアシルグリセロール酸化生成物が生成することを初めて示している.また,リポソーム中のジアシルグリセロールヒドロペルオキシドをリン脂質ヒドロペルオキシドグルタチオンペルオキシダーゼが還元することも示されている. 第7章は全体をまとめ結論を簡潔に述べている. 以上のように本論文は活性酸素・フリーラジカルによる生体膜の酸化によりリン脂質酸化物が生成し,これの修復のためにペルオキシダーゼや加水分解酵素が働くことを示し,さらに加水分解生成物の一つである酸化されたジアシルグリセロールがプロテインキナーゼCを介する細胞内情報伝達物質として作用することを見いだした優れた論文である.今後活性酸素・フリーラジカルによる生体障害の機構と防御の理解に大いに寄与すると考えられ,生命科学の進展に寄与するところ大である. よって,本論文は博士(工学)の学位請求論文として合格と認められる. |