| 内容要旨 | | 序論 Maitotoxin(MTX,1,Figure1)は渦鞭毛藻Gambierdiscus toxicusの産生するポリ環状エーテル化合物であり、二次代謝産物としては最大の分子量(3422Da)と最強の毒性(LD50=50ng/kg;mouse,i.p.)を併せ持つことから注目を集めている。しかし、これまでに行われた多くの薬理学的研究にも関わらず、活性発現機構の詳細については未だ解明されていない。MTXの極めて強力な生理活性発現機構を分子構造レベルで解明するうえで全立体構造、とりわけ絶対配置の決定は必要不可欠である。MTXの全平面構造、ついで縮合環状エーテル部分とそれらが炭素-炭素結合で連結された部分(K環-L環,O環-P環、V環-W環)の相対立体配置が、主に2次元NMR解析とタンデム質量分析を用いて決定された。しかし、絶対立体構造に加え、分子両末端の鎖状部分(C1-C15,C134-C142)および縮合エーテル環構造を繋ぐ鎖状部分(C35-C39,C63-C68)に存在する不斉点の帰属が完全構造決定への最大の障害となっていた。一般に、X線結晶構造解析が適用できない非結晶性化合物の立体構造解析には、NMRが中心的な役割を担っている。しかし、一定の立体配座をとらない化合物や鎖状化合物においてはNOEの解釈が複雑になり、一義的決定に至らないことが多い。他の解析法として、分子全体もしくは分解反応で得られる分子断片について可能な全ての立体異性体を合成し、クロマトグラフィーでの挙動やNMRスペクトルを比較する方法があるが、これについても、帰属しようとする不斉点の増加とともに合成が必要な立体異性体の総数が指数関数的に増加する、天然物の分解時に問題となる不斉点の情報が失われる等、適用範囲に限界がある。実際、上記の理由によりMTXの鎖状部分の解析には適用不可能である。 筆者はこれまでに、MTX鎖状部分の立体配置の決定を目指して、1)NMRによる立体構造の推定、2)推定構造に基づいた適切なモデル化合物のデザインおよび立体選択的合成、3)天然物の当該部分とのNMRデータの比較、という3段階から成る手法を用いて構造解析を行ってきた。この立体構造解析法の有効性については、MTXのC64-C67鎖状部の立体構造解析を通じて示すことができた。さらにこの手法はC36-C38鎖状部の構造解析にも適用され、MTXのA環からF’環までの相対立体配置が明らかになった。本研究では、残る両末端鎖状部のうち、主に分子末尾のC134-C142鎖状部の相対および絶対立体配置の決定について検討した結果、別途解明されたもう一方の末端鎖状部(C1-C14)の相対立体配置と併せてMTXの絶対配置を含めた全立体構造の解明に成功した。さらに、この構造情報を基に抗原抗体反応によるMTXの微量かつ特異的検出法の確立を目的とし、MTXの親水性領域C1-C11部分を認識する抗体を作成するためのハプテン合成について検討を行った結果、官能基の保護体としてこれを達成したと同時に、脱保護における問題点を明らかにすることが出来た。  Figure1.Complete structure of maitotoxin(MTX,1)第一章Maitotoxinの全立体配置の決定 Figure1.Complete structure of maitotoxin(MTX,1)第一章Maitotoxinの全立体配置の決定 C134-C138部分については、主に遠隔スピン結合定数(2.3JC,H,3JH,H)を用いた解析法により相対立体配置が推定されていたが(Figure2)、C134-C135,C135-C136の結合に関して複数の回転配座が混在しており、完全な帰属には至らなかった。そこで、この推定構造および配座交換の確認を目的として、C130-C139部分のモデル化合物2を立体選択的に合成し、天然物の相当する部分と各種スピン結合定数(2JC,H,3JH,H)による比較を行った。  Figure2.Relative configuration of the C134-C138 portion deduced from 2,3JC,H and 3JH,H(left),and model compound 2(right). Figure2.Relative configuration of the C134-C138 portion deduced from 2,3JC,H and 3JH,H(left),and model compound 2(right). 文献既知のアルコール3より得られる , , -不飽和エステル4にAD-mix -不飽和エステル4にAD-mix を用いた不斉オスミウム酸化を行い、良好な選択性(6:1)でC135,C136のジオール部を導入した。アセトニドに誘導してジアステレオマー6を分離後、炭素鎖を伸長して7とし、さらに6段階の反応を経て2を合成した(Scheme1)。これと天然物のC134-C135,C135-C136に関する全てのスピン結合定数の値が完全に一致したことから、MTXの当該部分の立体構造を確定した。これと平行して共同研究者らとともにC1-C14鎖状部の相対立体化学についても決定しており、C134-C138部分の解析結果とからMTXのC1-C138の相対立体配置を明らかにした。 を用いた不斉オスミウム酸化を行い、良好な選択性(6:1)でC135,C136のジオール部を導入した。アセトニドに誘導してジアステレオマー6を分離後、炭素鎖を伸長して7とし、さらに6段階の反応を経て2を合成した(Scheme1)。これと天然物のC134-C135,C135-C136に関する全てのスピン結合定数の値が完全に一致したことから、MTXの当該部分の立体構造を確定した。これと平行して共同研究者らとともにC1-C14鎖状部の相対立体化学についても決定しており、C134-C138部分の解析結果とからMTXのC1-C138の相対立体配置を明らかにした。  Scheme1:a)AD-mix Scheme1:a)AD-mix  ,OsO4(cat.),MeSO2NH2,1BuOH-H2O(1:1),RT,75%(5:6=1:6);b)CSA(cat.),Me2C(OMe)2,CH2Cl2,RT,then separation,46%;c)DIBAL,CH2Cl2,-78℃;d)Ph3P=C(Me)CO2Et,toluene,80℃,quant.(2 steps). ,OsO4(cat.),MeSO2NH2,1BuOH-H2O(1:1),RT,75%(5:6=1:6);b)CSA(cat.),Me2C(OMe)2,CH2Cl2,RT,then separation,46%;c)DIBAL,CH2Cl2,-78℃;d)Ph3P=C(Me)CO2Et,toluene,80℃,quant.(2 steps). 残る2つの不斉点C138,C139については、138-H,139-Hシグナルの多スピン系に由来する強度低下から十分な精度の二面角情報が得られないため、NMR解析による立体配置の推定は不可能であった。一方、MTXはNaIO4処理による1,2-ジオール部分の酸化的開裂、続くNaBH4還元により、3つの分子断片(Fragment A-C,Figure1)に分解されることが報告されている。そこで、これらのうち、C138,C139の立体化学を保持しているFragment C(3,4-dimethyl-6-hepten-1-ol)について可能な全ての立体異性体(8a-8d,Figure3)をエナンチオ選択的に合成し、天然物の分解物とキラルGCを用いて比較することにより、C138,C139の相対および絶対立体配置の同時決定を計画した。  Figure3.Four possible stereoisomers(8a-8d)for 3,4-dimethyl-6-hepten-1-ol Figure3.Four possible stereoisomers(8a-8d)for 3,4-dimethyl-6-hepten-1-ol 不斉点C138,C139の構築には、2,3-エポキシアルコールに対するAlMe3を用いた位置および立体選択的なメチル基導入を繰り返し行う段階的な不斉導入を検討した(Scheme2)。10へのメチル基の導入は完全な選択性で進行したのに対し、12へのメチル基導入では、予想とは逆のantiジメチル体13を主生成物として(13:14=7:3)与えた。これらを分離後、13より6段階の反応を経て138R,139S体8aを合成した。なお、8aの立体化学は絶対立体配置既知の光学活性ジオール16より別途誘導した138R,139R体8c(Scheme3)の1H,13C NMRデータおよびキラルGCにおける挙動が、14から誘導したものと一致したことからも確認できた。同様にして8a,8cそれぞれの鏡像体8b,8dを合成した。 4種の合成品8a-8dを用いてキラルGC-MSにおける条件の最適化を行った結果、完全な分離が達成された。新たに50 gのMTXを分解して得たFragment Cは、同一の分析条件において8aと保持時間が一致した。以上の結果より、MTXの絶対立体配置を138R,139Sであると決定し、MTXの絶対配置を含めた全立体構造を明らかにした(Figure1)。 gのMTXを分解して得たFragment Cは、同一の分析条件において8aと保持時間が一致した。以上の結果より、MTXの絶対立体配置を138R,139Sであると決定し、MTXの絶対配置を含めた全立体構造を明らかにした(Figure1)。  Scheme2:a)TBHP,Ti(OjPr)4,(+)-DET,CH2Cl2,4Å molecular sieves,-20℃,62%;b)AlMe3,hexane,0℃,97%;c)AlMe3,hexane,0℃,69%(13:14=7:3);d)NalO4,THF-H2O(1:1),RT;e)CH2l2,TiCl4,Zn,THF,RT;f)9-BBN,THF RT,then 30%H2O2,3M NaOH,RT;g)SO3・pyridine,Et3N,DMSO-CH2Cl2(1:5),0℃;h)Ph3P+CH3Br-,LiHMDS,THF,0℃;i)TBAF,THF,RT,17%(6steps). Scheme2:a)TBHP,Ti(OjPr)4,(+)-DET,CH2Cl2,4Å molecular sieves,-20℃,62%;b)AlMe3,hexane,0℃,97%;c)AlMe3,hexane,0℃,69%(13:14=7:3);d)NalO4,THF-H2O(1:1),RT;e)CH2l2,TiCl4,Zn,THF,RT;f)9-BBN,THF RT,then 30%H2O2,3M NaOH,RT;g)SO3・pyridine,Et3N,DMSO-CH2Cl2(1:5),0℃;h)Ph3P+CH3Br-,LiHMDS,THF,0℃;i)TBAF,THF,RT,17%(6steps).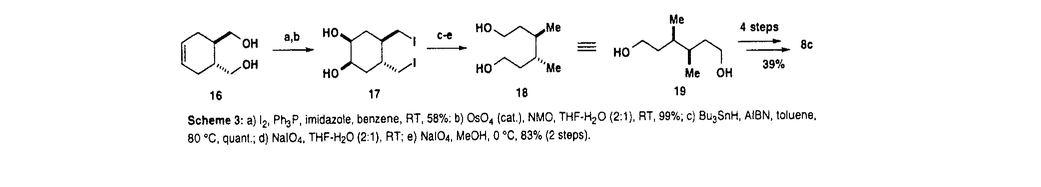 Scheme3:a)l2,Ph3P,imidazole,benzene,RT,58%;b)OsO4(cat.),NMO,THF-H2O(2:1),RT,99%;c)Bu3SnH,AlBN,toluene,80℃,quant.;d)NalO4,THF-H2O(2:1),RT;e)NalO4,MeOH,0℃,83%(2steps).第二章MaitotoxinのC1-C11部分の合成研究 Scheme3:a)l2,Ph3P,imidazole,benzene,RT,58%;b)OsO4(cat.),NMO,THF-H2O(2:1),RT,99%;c)Bu3SnH,AlBN,toluene,80℃,quant.;d)NalO4,THF-H2O(2:1),RT;e)NalO4,MeOH,0℃,83%(2steps).第二章MaitotoxinのC1-C11部分の合成研究 MTX分子は、親水性官能基に富む領域(C1-Q環)と、比較的、疎水性の高い領域(R環-C142)からなる両親媒性構造を有している。この構造的特徴から、MTXは細胞膜への結合時において疎水性領域は細胞膜に埋没するのに対し、親水性領域は細胞表層に露出するという結合様式が推測される。従って、MTXの親水性領域を認識する抗体を作成すれば、細胞膜への結合時におけるMTXの特異的な検出が可能である。そこで、抗原作成のためのハプテンとしてMTXの親水性領域のうちC1-C11部分を含むカルボン酸20およびアルデヒド21を、上に明らかにした立体構造に基づき合成標的とした(Figure5)。  Figure5 Figure5 8aの合成中間体11を出発原科とし、保護された全ての官能基と立体化学を備えた22までの合成法を確立した(Scheme4)。しかし、PMB基の脱保護に用いるDDQがジエン部分とDiels-Alder反応をおこす等の問題点が明らかになった。  Scheme4:a)AD-mix Scheme4:a)AD-mix  ,OsO4(cat.),1BuOH,H2O,lBuOMe(2:2:1),RT,95%,(5 ,OsO4(cat.),1BuOH,H2O,lBuOMe(2:2:1),RT,95%,(5 -OH:5 -OH:5 -OH=1:3);b)Swern oxidation;c)((E)-4-(triisopropylsilyloxy)-2-buten-2-yl)lithium,THF,-78℃,55%(2steps);d)Swern oxidation,71%;e)Ph3P=CH2,THF,0℃,66%;f)CSA(cat.),MeOH-CH2Cl2(1:1),RT,62%:g)Swem oxidation;h)(5-(1-ethoxyethoxy)-pentyl)lithium,-78℃,79%(2steps);i)Swern oxidation,95%:j)Zn(BH4)2,Et2O,20℃.81%;k)Ac2O,pyridine,RT,82%;l)CSA(cat.),MeOH-CH2Cl2(1:4),RT,82%;m)Swern oxidation;n)NaClO2,2-methyl-2-butene,NaH2PO4,1BuOH-H2O(7:3),0℃;o)TMSCHN2,CHCl3-MeOH(7:1),0℃,53%(3steps);p)K2CO3,MeOH,RT,27%;q)SO3・NMe3,pyridine. -OH=1:3);b)Swern oxidation;c)((E)-4-(triisopropylsilyloxy)-2-buten-2-yl)lithium,THF,-78℃,55%(2steps);d)Swern oxidation,71%;e)Ph3P=CH2,THF,0℃,66%;f)CSA(cat.),MeOH-CH2Cl2(1:1),RT,62%:g)Swem oxidation;h)(5-(1-ethoxyethoxy)-pentyl)lithium,-78℃,79%(2steps);i)Swern oxidation,95%:j)Zn(BH4)2,Et2O,20℃.81%;k)Ac2O,pyridine,RT,82%;l)CSA(cat.),MeOH-CH2Cl2(1:4),RT,82%;m)Swern oxidation;n)NaClO2,2-methyl-2-butene,NaH2PO4,1BuOH-H2O(7:3),0℃;o)TMSCHN2,CHCl3-MeOH(7:1),0℃,53%(3steps);p)K2CO3,MeOH,RT,27%;q)SO3・NMe3,pyridine. 以上の知見を踏まえ、21の合成ではPMB基はジエン部分の構築以前にTES基に変換し、アルデヒド基は1,2-ジオールとして合成、最終段階でNaIO4処理により変換することとした。これらの変更点を除き、ほぼ同様の合成法を用いて21への変換がより確実と推定される23の合成を達成した(Figure6)。  Figure6 Figure6 |