| 内容要旨 | | 哺乳類大脳の神経シナプス後膜に存在し,中枢神経系の情報伝達において中心的役割を果たしているグルタミン酸受容イオンチャンネル蛋白質(GluR)は,L-グルタミン酸等のアゴニストと結合すると分子内のチャンネルを開き,大量のカチオンを細胞の外側から内側へと透過させる.アゴニスト間のGluRに対する化学選択性を評価することは,GluRのもつ生理機能の理解やアゴニストの分子設計などのために重要である.従来,GluR等のレセプターイオンチャンネルのアゴニスト選択性は,レセプター蛋白とアゴニスト間の結合能に基づく,いわゆるbinding assayによって行われてきた.本研究では,それとは全く異なり,GluRのもつ生理機能である物質認識能及び情報変換/増幅能に基づいた新しいアゴニスト選択性の評価法を提案した.そのために,単離したGluR蛋白分子を人工平面脂質二分子膜に包埋して構築した化学的に制御された二分子膜系において,GluR分子がアゴニストを認識して透過させるイオンの総量(クーロン数:チャンネル電流値×時間)そのものの大きさを指標にNMDAサブタイプのGluRに対する選択性を評価した. 第1章では,脳研究における電気化学分析法について概説した.またGluR研究の歴史と,GluRの化学選択性の従来の評価法について考察した上で,本研究の目的を記述した. 第2章では,ラット全脳より単離したGluRを,単分子膜貼合わせ法により作成した平面脂質二分子膜中に複数個包埋してマルチチャンネルセンサー(図1a)を構築し,NMDAサブタイプのGluRの典型的アゴニストN-メチル-D-アスパラギン酸(NMDA),L-グルタミン酸,L-2-(カルボキシシクロプロピル)グリシン(L-CCG-IV)間の化学選択性を,各アゴニストが生起したマルチチャンネル応答(総イオン透過量)の大きさに基づいて評価した.  図1.実験系 図1.実験系 マルチチャンネル応答の大きさに影響を与える要因として,実験上以下の点が重要であることが分かった.(1)膜中に包埋されるGluRの数は,二分子膜の構成脂質,水相の溶液組成,プロテオリポソームの添加量を全て同一条件にしているにもかかわらず,膜ごとに異なった.(2)GluRには,薬理学的応答に基づいて分類される2種のサブタイプ(NMDA及びnon-NMDAサブタイプ)が存在するが,実際に膜中に包埋されるGluRのサブタイプも膜ごとに異なった.(3)NMDA及びL-CCG-IVのチャンネル応答は,-80mVから+80mVの範囲で印加電圧に対して直線的な電位依存性を示したが,L-グルタミン酸の応答は,-80mVから-40mVの範囲で直線性から負の方向にそれた.特に(1)と(2)は重要で,異なる膜間では,GluRの数及び種類が異なるためにアゴニストによって誘起されるチャンネル応答の大きさは比較できないことを示している.  図2.マルチチャンネル電流(a)及びシングルチャンネル電流(b)の例 図2.マルチチャンネル電流(a)及びシングルチャンネル電流(b)の例 以上の結果に基づけば,NMDAサブタイプに対するアゴニスト間の選択性は,GluRの数及び種類が一定とみなせる同一膜において,等濃度の2種類のアゴニストを順次加え,正の一定電圧下において各アゴニストが生起したチャンネル応答(総イオン透過量)の大きさを比べることによってのみ評価できる.この際,2種のアゴニスト間でGluRをめぐって競争反応が起こると予想されるので,できるだけ低い濃度(0.10nM)のアゴニストを用いた.また,特異的アンタゴニストDNQXを用いてnon-NMDAサブタイプを阻害し,NMDAザブタイプのみが活性となるようにした.その結果,図3に示すように,NMDAよりもL-グルタミン酸,L-グルタミン酸よりもL-CCG-IVの方が大きなチャンネル応答を誘起し,チャンネル活性能の序列がNMDA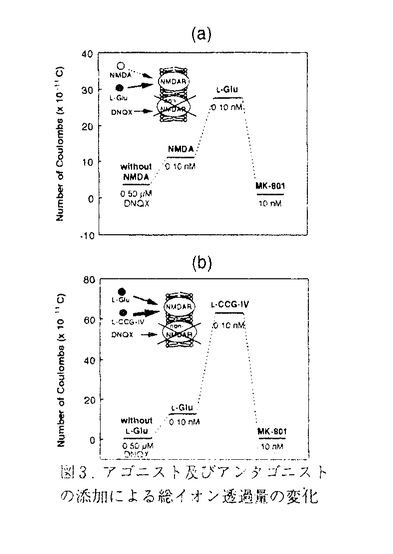 図3.アゴニスト及びアンタゴニストの添加による総イオン透過量の変化 図3.アゴニスト及びアンタゴニストの添加による総イオン透過量の変化 表1.シングルチャンネル応答に基づく 表1.シングルチャンネル応答に基づく 1/ 1/ 1種のNMDAサブタイプに対するアゴニスト選択性 1種のNMDAサブタイプに対するアゴニスト選択性 第3章では,第2章で用いたアプローチを,薬理学的応答に基づいて分類されるNMDAレセプターから,アミノ酸配列の相同性の基づいて分類されるNMDAレセプター分子種へと展開した.NMDAサブタイプのGluRにはアミノ酸配列の相同性に基づいた4種類の分子種( 1/ 1/ 1, 1, 2/ 2/ 1, 1, 3/ 3/ 1, 1, 4/ 4/ 1)が存在するが,本研究では,脳内に最も多く分布していることが知られている 1)が存在するが,本研究では,脳内に最も多く分布していることが知られている 1/ 1/ 1分子種を対象に用いた. 1分子種を対象に用いた. 1/ 1/ 1種のみを発現したCHO(Chinese hamster ovary)細胞から単離した 1種のみを発現したCHO(Chinese hamster ovary)細胞から単離した 1/ 1/ 1分子種を,Tip-dip法(図1b)及び単分子膜貼り合わせ法によって作成した平面脂質二分子膜中に包埋し,1個の 1分子種を,Tip-dip法(図1b)及び単分子膜貼り合わせ法によって作成した平面脂質二分子膜中に包埋し,1個の 1/ 1/ 1-分子種が透過させる総イオン量を指標とするアゴニスト選択性の評価を行った.第2章で用いたマルチチャンネル応答の比に基づいて選択性を評価するアプローチとは異なり,1個のレセプターを対象とするため,得られた総イオン透過量の値は, 1-分子種が透過させる総イオン量を指標とするアゴニスト選択性の評価を行った.第2章で用いたマルチチャンネル応答の比に基づいて選択性を評価するアプローチとは異なり,1個のレセプターを対象とするため,得られた総イオン透過量の値は, 1/ 1/ 1分子種と各アゴニストとの間の選択性の直接の指標となる.CHO細胞(三菱化学より提供)は,熱ショックを与えたときにだけ 1分子種と各アゴニストとの間の選択性の直接の指標となる.CHO細胞(三菱化学より提供)は,熱ショックを与えたときにだけ 1/ 1/ 1種を発現する.熱ショックを与えた細胞(HS+)及び与えなかった細胞(HS-)の両者から膜画分を抽出して用いた. 1種を発現する.熱ショックを与えた細胞(HS+)及び与えなかった細胞(HS-)の両者から膜画分を抽出して用いた. 膜中レセプター種を特定するため,NMDAサブタイプのGluRの特異的アゴニストNMDA及び特異的アンタゴニストのMK-801,電位依存性Na+チャンネルの特異的アンタゴニストのテトロドトキシン(TTX)に対する反応性を調べた.その結果,HS+蛋白を含む膜にはNMDAにチャンネル応答を示す 1/ 1/ 1分子種と電位依存性Na+チャンネルが存在し,一方HS-蛋白を含む膜には電位依存性Na+チャンネルのみが存在し,NMDAサブタイプは存在しないことが分かった.また,どちらの場合も10 1分子種と電位依存性Na+チャンネルが存在し,一方HS-蛋白を含む膜には電位依存性Na+チャンネルのみが存在し,NMDAサブタイプは存在しないことが分かった.また,どちらの場合も10 M TTXでNa+チャンネルの応答は完全に抑制されたため,以降の実験では始めから10 M TTXでNa+チャンネルの応答は完全に抑制されたため,以降の実験では始めから10 M TTXを膜の両側の水相に加えておくことにした.NMDA,L-グルタミン酸,L-CCG-IVに対するシングルチャンネル電流は,複数のコンダクタンスレベルを示すものが多く見られた.コンダクタンスレベルの大きさは,アゴニスト間で差は見られなかった.1秒間当たりの総イオン透過量は異なる膜間においてもよい一致を示し,その平均値(x10-13C/s)は,NMDA-が4.0,L-グルタミン酸が4.9,L-CCG-IVが6.8となった(表1).すなわち M TTXを膜の両側の水相に加えておくことにした.NMDA,L-グルタミン酸,L-CCG-IVに対するシングルチャンネル電流は,複数のコンダクタンスレベルを示すものが多く見られた.コンダクタンスレベルの大きさは,アゴニスト間で差は見られなかった.1秒間当たりの総イオン透過量は異なる膜間においてもよい一致を示し,その平均値(x10-13C/s)は,NMDA-が4.0,L-グルタミン酸が4.9,L-CCG-IVが6.8となった(表1).すなわち 1/ 1/ 1分子種と各アゴニストに固有の定数としてアゴニスト選択性を定めることができた.また,マルチチャンネル応答に基づいて得られたL-CCG-IVとL-グルタミン酸間の比は1.4 (n=3)となり,シングルチャンネル応答に基づく選択性の比(1.4)と一致した.この結果は,異なる膜系で得られたシングルチャンネル応答に基づく選択性と,同一膜系で得られたマルチチャンネル応答に基づく選択性が同じ結果を与えることを示しており,本アプローチの妥当性を示している. 1分子種と各アゴニストに固有の定数としてアゴニスト選択性を定めることができた.また,マルチチャンネル応答に基づいて得られたL-CCG-IVとL-グルタミン酸間の比は1.4 (n=3)となり,シングルチャンネル応答に基づく選択性の比(1.4)と一致した.この結果は,異なる膜系で得られたシングルチャンネル応答に基づく選択性と,同一膜系で得られたマルチチャンネル応答に基づく選択性が同じ結果を与えることを示しており,本アプローチの妥当性を示している. 1/ 1/ 1 NMDAレセプターと機能的に等価なNR1/NR2Aレセプターについて報告されている結合能の比(NMDA:L-グルタミン酸=0.064:1.0)と比較すると,NMDAとL-グルタミン酸が生起したチャンネル応答の大きさの比を求めて得られた選択性(NMDA:L-グルタミン酸=0.82:1.0)は,結合能の比と比べて著しく縮まっていた. 1 NMDAレセプターと機能的に等価なNR1/NR2Aレセプターについて報告されている結合能の比(NMDA:L-グルタミン酸=0.064:1.0)と比較すると,NMDAとL-グルタミン酸が生起したチャンネル応答の大きさの比を求めて得られた選択性(NMDA:L-グルタミン酸=0.82:1.0)は,結合能の比と比べて著しく縮まっていた. 第4章では,ラット脳より単離したNMDAレセプターを対象に,シングルチャンネル応答に基づいてアゴニスト選択性を評価した.平面脂質二分子膜は,単分子膜貼合わせ法及びTip-dip法によって作成した.NMDA,L-グルタミン酸,L-CCG-IVに対するシングルチャンネル電流は, 1/ 1/ 1 NMDAレセプター分子種の場合と同様に,複数のコンダクタンスレベルを示すものが多く見られた.1秒間当たりの総イオン透過量は,L-グルタミン酸とL-CCG-IVに対しては大きな値を示す場合と,小さな値を示す場合の2つの分布を示した(表2).脳には4種類の分子種のNMDAサブタイプのGluRが混在するため,分子種の異なるNMDAサブタイプが膜に融合されたため異なる大きさの総イオン透過量を示したと考えられる.この結果は,1個のNMDAレセプターを透過するイオン量によって,今まで識別することができなかった脳内のNMDAレセプター分子種を同定できる可能性を示している. 1 NMDAレセプター分子種の場合と同様に,複数のコンダクタンスレベルを示すものが多く見られた.1秒間当たりの総イオン透過量は,L-グルタミン酸とL-CCG-IVに対しては大きな値を示す場合と,小さな値を示す場合の2つの分布を示した(表2).脳には4種類の分子種のNMDAサブタイプのGluRが混在するため,分子種の異なるNMDAサブタイプが膜に融合されたため異なる大きさの総イオン透過量を示したと考えられる.この結果は,1個のNMDAレセプターを透過するイオン量によって,今まで識別することができなかった脳内のNMDAレセプター分子種を同定できる可能性を示している. 第5章では,全体の総括と将来の展望について考察した.レセプターイオンチャンネル蛋白のもつ物質認識能及び情報変換/増幅能に基づく総イオン透過量を,アゴニスト選択性の指標に用いる本法は,GluRのみならず,他のレセプターイオンチャンネル蛋白にも適応できる一般的な方法である.  表2.シングルチャンネル応答に基づくラット脳由来のNMDAサブタイプに対するアゴニスト選択性 表2.シングルチャンネル応答に基づくラット脳由来のNMDAサブタイプに対するアゴニスト選択性 |
| 審査要旨 | | 本論文は4章からなり,第1章は序論,第2章はラット脳由来のグルタミン酸受容イオンチャンネル蛋白(GluR)のマルチチャンネル応答に基づくアゴニスト選択性について記述している.第3章及び第4章では,シングルチャンネル応答に基づく 1/ 1/ 1 N-メチル-D-アスパラギン酸(NMDA)レセプター及びラット脳由来のGluRに対する選択性について各々論じている.第5章は,総合的な結論を述べている. 1 N-メチル-D-アスパラギン酸(NMDA)レセプター及びラット脳由来のGluRに対する選択性について各々論じている.第5章は,総合的な結論を述べている. 第1章序論では,脳研究における電気化学分析法とGluR研究の歴史及びGluRのアゴニスト選択性の従来の評価法について概説している.従来,GluR等のレセプターイオンチャンネルのアゴニスト選択性の評価は,レセプター蛋白とアゴニスト間の結合能を評価するbinding assayによって行われてきた.本論文では,それとは全く異なり,GluRのもつ生理機能である物質認識能及び情報変換/増幅能に基づいた新しいアゴニスト選択性の評価法を創案することを研究目的としている. 第2章では,ラット全脳より単離したGluRを,単分子膜貼合わせ法により作成した平面脂質二分子膜中に複数個包埋してマルチチャンネルセンサーを構築し,NMDAサブタイプのGluRの典型的アゴニストN-メチル-D-アスパラギン酸(NMDA),L-グルタミン酸,L-2-(カルボキシシクロプロピル)グリシン(L-CCG-IV)間の化学選択性を,各アゴニストが生起したマルチチャンネル応答(総イオン透過量:電流値×時間)の大きさに基づいて評価している.得られた選択性は,NMDA:L-グルタミン酸:L-CCG-IV=0.47:1.0:2.9となり,アゴニストとGluRとの結合能の比のNMDA:L-グルタミン酸:L-CCG-IV=0.022:1.0:17と比べて著しく縮まっていることを見出している.本法は,結合能に基づくbinding assayとは異なり,GluRのもつ物質認識,情報変換/増幅能に基づいており,より生理適合性のある選択性を与える方法であると結論している. 第3章では,第2章で用いたアプローチを,薬理学的応答に基づく分類のNMDAレセプターから,アミノ酸配列の相同性の基づく分類のNMDAレセプター分子種へと展開している.NMDAサブタイプのGluRには4種類の分子種( 1-4/ 1-4/ 1)が存在するが,本論文では,脳内に最も多く分布している 1)が存在するが,本論文では,脳内に最も多く分布している 1/ 1/ 1分子種を対象としている. 1分子種を対象としている. 1/ 1/ 1種のみを発現したCHO(Chinese hamster ovary)細胞から単離した 1種のみを発現したCHO(Chinese hamster ovary)細胞から単離した 1/ 1/ 1-分子種を,tip-dip法及び単分子膜貼り合わせ法によって作成した平面脂質二分子膜中に包埋し,1個の 1-分子種を,tip-dip法及び単分子膜貼り合わせ法によって作成した平面脂質二分子膜中に包埋し,1個の 1/ 1/ 1分子種が透過させる総イオン量を指標にアゴニスト選択性を評価している.総イオン透過量(x10-13C/s)は,NMDA:4.0,L-グルタミン酸:4.9,L-CCG-IV:6.8となり, 1分子種が透過させる総イオン量を指標にアゴニスト選択性を評価している.総イオン透過量(x10-13C/s)は,NMDA:4.0,L-グルタミン酸:4.9,L-CCG-IV:6.8となり, 1/ 1/ 1分子種と各アゴニストに固有の値としてアゴニスト選択性と定めることに成功している. 1分子種と各アゴニストに固有の値としてアゴニスト選択性と定めることに成功している. 1/ 1/ 1分子種と機能的に等価なNR1/NR2Aレセプターの結合定数から考えると,用いたアゴニスト濃度(50 1分子種と機能的に等価なNR1/NR2Aレセプターの結合定数から考えると,用いたアゴニスト濃度(50 M)では, M)では, 1/ 1/ 1分子種はほとんど常に結合状態にある.そのため総イオン透過量は,結合能よりもレセプターの情報変換/増幅能を反映する値となる.得られた結果は,L-CCG-IVはNMDAやL-グルタミン酸と比べて,レセプターの情報変換能をより強く活性化する能力をもつことを示すと結論している. 1分子種はほとんど常に結合状態にある.そのため総イオン透過量は,結合能よりもレセプターの情報変換/増幅能を反映する値となる.得られた結果は,L-CCG-IVはNMDAやL-グルタミン酸と比べて,レセプターの情報変換能をより強く活性化する能力をもつことを示すと結論している. 第4章では,ラット脳より単離したNMDAレセプターを対象に,シングルチャンネル応答に基づいてアゴニスト選択性を評価している.1秒間当たりの総イオン透過量は,L-グルタミン酸とL-CCG-IV-に対しては大きな値を示す場合と,小さな値を示す場合の2つの分布が存在することを見出した.この結果から,脳内のNMDAレセプター分子種を,1個のNMDAレセプターを透過するイオン量に基づいて同定できる可能性について考察している. 第5章では,全体の総括と将来の展望について論じている. レセプターイオンチャンネル蛋白のもつ物質認識能及び情報変換/増幅能に基づく総イオン透過量を,選択性の指標に用いる本論文の方法は,アゴニスト選択性の評価法として,他のレセプターイオンチャンネル蛋白にも適応できる一般的な方法である. 本研究は,分析化学において重要なものであり,博士(理学)取得を目的とする研究として十分であると審査委員会は全員一致で認めた.なお,本研究は各章の研究が複数の研究者との共同研究であるが,論文提出者が主体となって行ったもので,論文提出者の寄与は十分であると判断する. したがって,博士(理学)の学位を授与できると認める. |