チロシンキナーゼを介した細胞内シグナル伝達が細胞増殖、分化さらには免疫系や神経系の高次機能に必要なことが明らかにされてきている。チロシンキナーゼは大きく受容体型と非受容体型(細胞質型)に分類され、Rous Sarcoma Virus(RSV)のv-srcの研究を発端に解析の進んだSrc型チロシンキナーゼ(src,yes,fgr,fyn,lyn,lck,blk,hck,yrk)は後者に属する。その遺伝子産物はSH3(Src-Homology 3)、SH2、キナーゼ(SH1)領域と呼ばれるドメイン構造を持つ、分子量約60kDaの蛋白であり、アミノ末端領域の脂質化により細胞膜の内側に局在している。Src型チロシンキナーゼの機能は主に免疫系細胞のシグナル伝達機構と細胞癌化機構の観点から解明され、それに比べ神経系における機能解析は遅れをとっていた。しかし、神経系での重要性はfyn欠損マウスに海馬での長期増強の減弱や空間記憶の障害などの異常が見られることからも明かであった。そこで筆者は神経系でのSrc型キナーゼの生理的意義付けをするため、キナーゼの制御因子(活性化刺激など)および基質となる下流分子の同定を試みた。 <第1章:Src型チロシンキナーゼ、Lyn及びFynとcbl癌原遺伝子産物との物理的、機能的相互作用> Lynは神経系では小脳や脳幹に発現が多く見られる。Lynの未知のターゲット分子をYeast Two Hybrid Systemで検索した。4週齢ラット脳mRNAよりcDNAを合成した。それをpGAD424に挿入して、Two Hybrid Screen用のcDNAライブラリーとして用いた。Lynのアミノ末側235アミノ酸残基をプローブとしてスクリーニングしたところ、ポジティブクローンの1つはcbl癌原遺伝子産物p120ocbl(以後、Cblと記す)のカルボキシル末側470アミノ酸残基をコードしていた。この領域はプロリンに富む配列を含むことから、このクローンはこのプロリンに富む配列とLynのSH3との結合によって単離されたものと考えられる(図1-1)。Cblは他にPTB(phosphotyrosine-binding)ドメイン、RINGフィンガーなどのモチーフを持つ120kDaの細胞質蛋白である。cblは脳でも発現しているが、胸腺、精巣や脾臓でより高く発現している。Lynは免疫系では、B細胞抗原受容体複合体や高親和性Fc受容体を介するシグナル伝達に関与している。そこで解析の容易さを考え、B細胞においてLynとCblとの物理的・機能的相互作用を検討した。まずラット脾臓を用い、細胞内でのCblとLynおよび他のSrc型チロシンキナーゼとの物理的会合を免疫共沈法によって調べた。その結果、CblとLyn及びFynとの会合が見られた。次にマウスB細胞系培養細胞WEHI-231において抗原受容体刺激によりCblが一過性にチロシンリン酸化されることを示した。さらにトリB細胞系培養細胞DT40の野生株、lyn欠損株及びsyk欠損株を用い、Cblのチロシンリン酸化がLynに依存することを見い出した。一方T細胞では抗原受容体を介するシグナル伝達にFynが重要である。T細胞でFynとCblとの相互作用を調べた。野生型及びfyn欠損マウス由来の脾臓T細胞を用いた結果、T細胞抗原受容体刺激に伴うCblのリン酸化にFynが重要であることを示された。 本研究はSrc型チロシンキナーゼとCblとの物理的、機能的相互作用がリンパ球の活性化に普遍的な役割を果たしていることを示唆している(図1-2)。cblは神経系でも発現しており、Src型キナーゼとCblとの相互作用は神経細胞においても機能していると考えられる。  図1-1 Lyn及びCblの構造Two-Hybrid Screeningの際のプローブ及び単離されたクローンがコードする領域を横線で示した。G-M/B:ミリスチン酸付加部位;PTB:リン酸化チロシン結合ドメイン 図1-1 Lyn及びCblの構造Two-Hybrid Screeningの際のプローブ及び単離されたクローンがコードする領域を横線で示した。G-M/B:ミリスチン酸付加部位;PTB:リン酸化チロシン結合ドメイン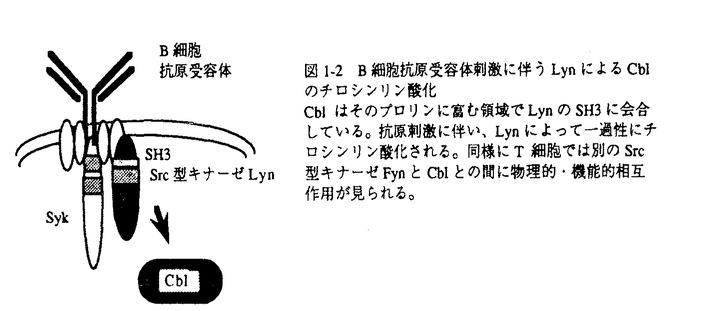 図1-2 B細胞抗原受容体刺激に伴うLynによるCblのチロシンリン酸化Cblはそのプロリンに富む領域でLynのSH3に会合している。抗原刺激に伴い、Lynによって一過性にチロシンリン酸化される。同様にT細胞では別のSrc型キナーゼFynとCblとの間に物理的・機能的相互作用が見られる。<第2章:Src型チロシンキナーゼFynとシナプス局在蛋白質PSD-95及びNMDA型グルタミン酸受容体との相互作用> 図1-2 B細胞抗原受容体刺激に伴うLynによるCblのチロシンリン酸化Cblはそのプロリンに富む領域でLynのSH3に会合している。抗原刺激に伴い、Lynによって一過性にチロシンリン酸化される。同様にT細胞では別のSrc型キナーゼFynとCblとの間に物理的・機能的相互作用が見られる。<第2章:Src型チロシンキナーゼFynとシナプス局在蛋白質PSD-95及びNMDA型グルタミン酸受容体との相互作用> fyn欠損マウスは海馬での長期増強 (long-term potentiation、以下LTP)や空間記憶、海馬構築またミエリン形成など、神経系において様々な異常を示す。しかし、神経系でのFynを介するシグナル経路はほとんど解明されていない。筆者はFynの中枢神経系における基質の1つにNMDA型グルタミン酸受容体のサブユニットNMDAR2A(以下NR2Aと記す)を同定した。NMDA受容体はCa2+透過性のイオンチャネルであり、LTPなどのシナプス可塑性や神経細胞死に重要である。その受容体は2種類の相同性の高いサブユニット、NR1とNR2(NR2A-NR2D)から構成される。fyn欠損マウスでは野生型と比較してNMDAR2Aのチロシンリン酸化レベルが半分以下に減少していた。またNR2Aを293T細胞に活性型Fynと共発現させるとNR2Aのチロシンリン酸化が確認された。NMDA受容体のイオンチャネル活性はSrc型チロシンキナーゼによって増強されるという報告がある。従って、NR2Aのチロシンリン酸化を介するNMDA受容体の増強はFynがシナプス可塑性に寄与するメカニズムの1つであると考えられる。NMDA受容体はグルタミン酸作動性ニューロンの後シナプス(特にpostsynaptic density、以下PSD)に局在する。NMDA受容体を制御する分子も受容体と局在が一致もしくは重複すると考えられ、実際FynはPSD画分に濃縮される。近年、NMDA受容体またカリウムチャネルなどをクラスター化させる機能を持つ分子として、後シナプス局在蛋白質PSD-95及びその分子ファミリーが同定された。PSD-95はアミノ末側から、3つのPDZドメイン(PSD-95/Dlg/ZO-1,PDZ1-PDZ3)、SH3、グアニル酸キナーゼ相同ドメインを持つ蛋白質である。PSD-95はそのPDZ1及びPDZ2ドメインによって、NR2(NR2A-2D)のカルボキシル末端と結合する。筆者はまずPSD-95がFynによるNMDAR2Aのチロシンリン酸化に影響するかどうかを検討した。293T細胞にNR2A、活性型Fyn及びPSD-95を組み合わせて、一過性に発現させた。そのNR2Aのチロシンリン酸化を検討した結果、PSD-95がFynによるNR2Aのチロシンリン酸化を促進することを見いだした。次にこの現象の分子メカニズムを調べた。まずPSD-95のFynのキナーゼ活性に対する影響をin vitroキナーゼアッセイによって検討したが、PSD-95はFynの自己リン酸化能また外来基質エノラーゼへのリン酸化能いずれにも影響しなかった。次にPSD-95がFynと会合し、その会合を通じてFynとNR2Aとの複合体形成を促進する可能性を免疫共沈法により調べた。293T細胞にNR2A、PSD-95及びFynの組み合わせで一過性に発現させ、その細胞の膜画分可溶化物から抗Fyn及び抗PSD-95抗体で免疫沈降した。その結果、Fyn免疫沈降物中にPSD-95が、逆にPSD-95免疫沈降物中にFynが検出され、両者の会合が確認された。さらにPSD-95存在下でのみFyn免疫沈降物中にNR2Aが確認され、PSD-95を介するFyn、PSD-95及びNR2Aの3者の複合体形成が示された。さらに野生型及びfyn欠損マウスを用いて、シナプトソーム画分からの免疫共沈実験を行い、実際の脳内でのPSD-95とFyn及び他のSrc型チロシンキナーゼとの会合を証明した。次にPSD-95とFynとの会合に必要な領域を同定した。Fyn側はFyn-SH2ドメインが関わっていた。一般にSH2ドメインはリン酸化チロシンを含む配列を認識する。しかしFynのキナーゼ不活化型変異体及びSH2変異体を用いた結果、PSD-95とFynとの会合はPSD-95のリン酸化に依存しなかった。実際、脳内でのPSD-95のチロシンリン酸化は検出できない。また種々のPSD-95の部分欠失体を作製して、PSD-95のFyn結合部位をPDZ3を含む177アミノ酸残基内に同定した(図2-1)。PSD-95のNR2結合部位はPDZ1及びPDZ2であり、従ってNR2AとFynは互いにPSD-95の別の領域に会合することが示された。さらに、これらのPSD-95変異体の解析から、PSD-95がNR2A及びFynの両方と会合することがFynによるNR2Aのチロシンリン酸化の促進に必要であった(図2-1)。  図2-1 PSD-95の構造、及び野生型、変異体の性質数字はPSD-95のアミノ酸番号を示す。wt:wild-type(野生型) 図2-1 PSD-95の構造、及び野生型、変異体の性質数字はPSD-95のアミノ酸番号を示す。wt:wild-type(野生型) 本研究で、PSD-95にFyn(及び他のSrc型チロシンキナーゼ)のシナプスにおけるアンカー蛋白としての機能を新たに見いだした。この相互作用により、Fynは基質の1つであるNMDA型グルタミン酸受容体イオンチャネルと局在を共にし、リン酸化によるチャネルの制御を効率良く行うと考えられる(図2-2)。  図2-2 Fyn、PSD-95及びNR2Aの複合体形成PSD-95はシナプスにおけるFynのアンカー蛋白として機能し、PSD-95を介してFynは基質の1つNR2Aと複合体を形成する。 図2-2 Fyn、PSD-95及びNR2Aの複合体形成PSD-95はシナプスにおけるFynのアンカー蛋白として機能し、PSD-95を介してFynは基質の1つNR2Aと複合体を形成する。 |