学位論文要旨
| No | 113282 | |
| 著者(漢字) | 松本,義久 | |
| 著者(英字) | Matsumoto,Yoshihisa | |
| 著者(カナ) | マツモト,ヨシヒサ | |
| 標題(和) | DNA依存性プロテインキナーゼの性質と放射線応答における機能 | |
| 標題(洋) | Molecular properties and function of DNA-dependent protein kinase in radiation response | |
| 報告番号 | 113282 | |
| 報告番号 | 甲13282 | |
| 学位授与日 | 1998.03.30 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(理学) | |
| 学位記番号 | 博理第3428号 | |
| 研究科 | 理学系研究科 | |
| 専攻 | 生物化学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 電離・非電離放射線は、細胞の遺伝情報を担うDNAに種々の傷害を与え、細胞死、変異、ガン化などを引き起こす。X線に代表される電離放射線の場合、DNAの2重鎖切断がこれらの放射線生物学的現象の担い手であると考えられ、細胞は様々な方法でDNA2重鎖切断を修復する。また、細胞は放射線に応答して、G1/S期やG2/M期における細胞周期進行の停止やアポトーシスによる細胞死などを起こす。 DNA依存性プロテインキナーゼ(DNA-PK)は、触媒サブユニットDNA-PKcsとKu抗原ヘテロダイマーKu86およびKu70の3つのポリペプチドから構成されるプロテインキナーゼである。DNA-PKの活性化には2本鎖DNAへの結合が必要であり、また、DNA-PKはp53、Replication protein A(RPA)をはじめとする数多くの核タンパク質をリン酸化する。近年、DNA-PKの3つのサブユニットのうち、DNA-PKcsがV(D)J組換えに欠陥があり、放射線に高感受性を示すマウスscid(severe combined immunodeficiency)変異の原因遺伝子であることが報告された。また、p85がXRCC5(X-ray repair cross-complementing)遺伝子産物であり、いくつかの電離放射線感受性変異細胞で欠損していることが報告された。これらのことから、DNA-PKはDNA2重鎖切断の認識や再結合において、重要な役割を担う酵素である可能性が示唆される。 本研究では、まず、ヒト白血病由来MOLT-4細胞核抽出液から、DEAE陰イオン交換カラム2回とDNA-celluloseカラムの計3段階のカラムクロマトグラフィーにより、DNA-PKを精製した。精製したDNA-PK画分は、これまでHeLaおよびRaji細胞から精製が報告されたものと同様に、470kDa、86kDa、70kDaの3本のメインバンドを含んでいた(図1)。470kDa、86kDa、70kDaのバンドはそれぞれ、DNA-PKcs、Ku86、Ku70に対する抗体に反応した。更に、精製DNA-PKをグリセロール濃度勾配中で超遠心することにより、DNA-PKcsとKuサブユニットに分離した。超遠心後の各画分についてリン酸化活性を検討したところ、リン酸化活性はDNA-PKcs画分に顕著に見られた(図2)。リン酸化活性はKu画分のみではほとんど見られなかったが、DNA-PKcsにKuを加えることによりリン酸化活性が促進された(図3)。このことから、DNA-PKcsがリン酸化触媒活性を持ち、Kuサブユニットはこれを増強する役割があることが判明した。  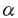 -カゼインリン酸化活性。B.SDS-PAGEパターン。 -カゼインリン酸化活性。B.SDS-PAGEパターン。  精製したDNA-PKホロ酵素と、分離したサブユニットに対する44℃温熱処理の影響を調べた。まず、DNA-PKホロ酵素を37℃または44℃で処理した後の活性を測定した。44℃では5分間処理から活性の低下が見られたが、37℃では30分間処理してもほとんど活性が低下しなかった(図4)。次に、分離したサブユニットの44℃温熱処理感受性を調べるため、p470画分とKu画分を別々に37℃あるいは44℃で処理した後、両者を混ぜ合わせてリン酸化活性を測定した(図5)。44℃処理したKuと37℃処理したp470を混ぜ合わせたとき活性は、37℃処理したKuと37℃処理したp470を混ぜ合わせたときより顕著に低下していた。一方、37℃処理したKuと44℃処理したp470を混ぜ合わせたときの活性は37℃処理したKuと37℃処理したp470を混ぜ合わせたときとほとんど変わらなかった。更に、44℃処理したKuと44℃処理したp470を混ぜ合わせたときの活性は、44℃処理したKuと37℃処理したp470を混ぜ合わせたときの活性とほぼ同じであった。以上から、DNA-PKは44℃温熱処理に対して不安定であり、Kuサブユニットが温熱不安定性の原因であることが示唆された。   細胞内のDNA-PKの温熱安定性を調べるために、44℃でさまざまな時間処理した細胞から粗抽出液を調製し、DNA-PK活性を測定した。調べた8種類の細胞のうち、3種類のげっ歯類細胞(V79、FM3A、FSA)では、60分以内の温熱処理で、DNA-PK活性が3分の1あるいはそれ以下に低下した。一方、5種類のヒト細胞(MOLT-4、U937、HL60、MKN-45、A7)は、60分処理までの温熱処理後も未処理のものとほとんど同等のDNA-PK活性を示し、180分処理後においても40%以上の活性を維持していた。これらの結果から、DNA-PKはげっ歯類細胞内で温熱処理に対して不安定であるが、ヒト細胞内では安定であることが示唆された。 温熱処理はがん治療に、しばしば放射線と組み合わせて用いられる。温熱処理と放射線を組み合わせる生物学的意義としては、放射線感受性が低いS期細胞が温熱処理に高感受性であること、そして、放射線によって生じた細胞傷害の修復能力が温熱処理によって低下することが挙げられる。DNA切断は放射線によって生じる細胞傷害の中で最も致命的なものと考えられることから、温熱処理による放射線増感作用はDNA切断の修復酵素の不活性化によるところが大きいと考えられている。一方、最近になっていくつかの放射線感受性細胞でDNA-PKのサブユニットが欠損していることが示され、DNA-PKが放射線で生じたDNA傷害、とくに2重鎖切断の認識や修復に重要な役割を担う酵素であることが強く示唆されている。また、一般的にヒト細胞の温熱による放射線増感効果がげっ歯類細胞に比べて小さいという報告がこれまでにいくつかあるが、本研究で、DNA-PKはげっ歯類細胞内で温熱処理に対して不安定であるが、ヒト細胞内では安定であることを示した。これらのことを考え合わせ、本研究で示したDNA-PK、特にそのKuサブユニットの温熱不安定性は、放射線によって生じた2重鎖切断の認識や修復の傷害を介して、温熱処理による放射線増感作用の原因の1つとなっている可能性が示唆された。 | |
| 審査要旨 | 本論文は、DNA依存性プロテインキナーゼ(DNA-PK)の性質と放射線応答における機能、特に、DNA-PKの温熱に対する不安定性と温熱による放射線感受性の増強作用の関係について行った研究について述べられている。 DNA-PKは、触媒サブユニットであるDNA-PKcs(p470)とKuヘテロダイマーKu86/Ku70の3つのポリペプチドから構成されるタンパク質リン酸化酵素である。DNA-PKは2重鎖DNAの端に結合することにより活性化されること、また、DNA-PKcsおよびKu86サブユニットがそれぞれ放射線高感受性およびDNA2重鎖切断修復の欠陥を示す細胞で欠損していることが報告され、DNA-PKが放射線によって生じたDNA2重鎖切断の認識や修復に重要な機能を担っていると考えられる。 本研究は、放射線に高感受性の細胞死を起こすヒト白血病由来MOLT-4細胞からDNA-PKを精製し、更にDNA-PKcsとKuサブユニットに分離し、各成分の性質、機能を調べ、DNA-PKの性質と放射線高感受性との関わりを調べることを目的として行われた。3段階のカラムクロマトグラフィー、ついでグリセロール濃度勾配遠心を行うことにより、DNA-PKcsとKuサブユニットを互いに分離した。分離したサブユニット単独、あるいは両サブユニット共存下でのリン酸化活性を検討した結果、DNA-PKcsがリン酸化触媒活性を持ち、Kuサブユニットはこれを増強する役割があることが判明した。以上の解析より、MOLT-4細胞の放射線高感受性はDNA-PKの異常ではないと結論された。 また、精製DNA-PKを44℃温熱前処理すると、活性が顕著に低下することを見出した。更に、DNA-PKcsとKuを別々に温熱前処理し、両者を混ぜ合わせてリン酸化活性を測定したところ、DNA-PKの温熱処理による失活はKuサブユニットに起因することが判明した。以上の結果から、DNA-PK、特にKuサブユニットの温熱不安定性により、放射線照射後のDNA2重鎖切断の修復や情報伝達の障害が増強され、温熱処理が放射線作用を著しく増大させる可能性が示唆された。 更に、細胞内のDNA-PKの温熱安定性を調べるために、さまざまな時間44℃温熱処理した細胞から粗抽出液を調製し、DNA-PK活性を測定した。調べた8種類の細胞のうち、3種類のげっ歯類細胞ではいずれも44℃温熱処理によりDNA-PK活性が顕著に低下したが、5種類のヒト細胞はいずれも温熱処理後も非処理のものとほとんど同等のDNA-PK活性を示した。これらの結果から、DNA-PKはげっ歯類細胞内で温熱処理に対して不安定であるが、ヒト細胞内では安定であることが示唆された。 温熱療法は、しばしば放射線と組み合わせてがん治療に用いられる。温熱によって放射線の腫瘍細胞致死効果が増強される原因については分子レベルでは十分明らかにされていないが、放射線感受性が低いS期細胞が温熱処理に高感受性であること、そして、放射線によって生じた細胞傷害の修復能力が温熱処理によって低下することが知られていた。特に、DNA2重鎖切断は放射線によって生じる細胞傷害の中で最も致命的なものと考えられ、温熱処理による放射線増感作用にDNA切断の修復酵素の不活性化の関与が考えられていた。本研究はDNA-PK、特にそのKuサブユニットの温熱不安定性のため、放射線によって生じたDNA2重鎖切断の認識や修復が阻害され、温熱処理による放射線増感作用の原因の1つとなっている可能性を示した。また、これまで、ヒト細胞の温熱による放射線増感効果がげっ菌類細胞に比べて小さい傾向があることが指摘されていたが、本研究はげっ歯類に比べてヒト細胞内でDNA-PKが温熱処理に対してより安定なため、温熱の放射線致死効果の増強が小さい可能性を示した。 なお、本研究は、鈴木紀夫、酒井一夫、森松暁史、平野和也、室伏擴との共同研究の部分を含むが、MOLT-4細胞のDNA-PKの精製・分離・解析にはじまり、本論文提出者が主体となって行ったものと認められ、博士(理学)の学位の授与に十分値する内容である。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54622 |