| 内容要旨 | | 構造生物学においてはタンパク質の機能,構造の解析が重要である.その解析法のうちで,NMR法は水溶液中での構造を解析することができる,運動性に関する情報を得ることができるといった特徴がある.NMR法を用いて解析を行うためには,得られたシグナルがタンパク質のどの部分に起因するのかを帰属する必要がある.タンパク質の分子量が大きくなるにつれてシグナルの数が増加し重なりも激しくなり帰属が困難となる.重なりを軽減するために13C,15N,2H等によるタンパク質のユニフォームな安定同位体標識法を用いてシグナルを分離する技術が一般的に使用されている.しかし,これらの標識法を用いても,分子量が30kDaをこえるようなタンパク質の解析,ならびにタンパク質間相互作用の解析は困難であった. このような系では,ある一残基だけを選択的に安定同位体標識(部位特異的な標識)したタンパク質をつくることができれば,アイソトープフィルターと組み合わせた測定を行うことにより,煩雑なシグナル帰属作業が不要となる.そして,直ちにその残基近傍の構造や運動性に関する情報を引き出すことが可能となる.この標識法は今まではNMR法での解析が困難であった,分子量の大きなタンパク質,ならびにタンパク質間相互作用の解析に役立つ.生体中に存在するタンパク質のうち,分子量が30kDaに満たないものは1/3以下(S.cerevisiaeの場合1)であるため,この標識法によりNMR法を用いて解析可能なタンパク質の範囲は大きく広がる. 部位特異的な安定同位体標識法は無細胞タンパク質合成系とサプレッサーtRNAを用いて実現できる.この方法により標識タンパク質を合成し,FT-IRによる解析に応用した例2が報告されているが,タンパク質合成量が少なく,NMR法に応用するためには実用的でなかった. 本研究の第一の目的は,部位特異的に安定同位体標識されたタンパク質を大量に合成する方法を確立し,NMR法の適用可能なタンパク質の範囲を拡大することである.そこで,ヒトがん遺伝子c-Ha-rasの産物,Rasタンパク質をモデルケースとしてTyr32残基に特異的な15N-安定同位体標識を行った.本研究で確立した,標識タンパク質の合成法を図1に示す.まず,チロシンアンバーサプレッサーtRNATyrCUAをT7RNA polymeraseによるin vitro転写反応により調製した.次いで,精製した大腸菌由来のtyrosyl-tRNA-synthetase(TyrRS)とL-[15N]tyrosineを用いてtRNATyrCUAのアミノアシル化反応を行った.標識部位(Tyr32)のコドンをアンバー(TAG)に置換した鋳型DNAと,アミノアシル化されたtRNATyrCUAを大腸菌由来の無細胞タンパク質合成系(転写翻訳共役系)に加え,タンパク質合成を行なった.合成系内では,鋳型DNAより転写されたmRNAのアンバーコドン(UAG)がtRNATyrCUAにより特異的に認識されて,L-[15N]tyrosineがTyr32に組み込まれた.30mlの反応液よりタンパク質を精製したところ,2.2mgの[15N]Tyr32-Rasタンパク質精製標品を得ることができた.そして,[15N]Tyr32-Rasタンパク質の1H-15N HSQCスペクトルの測定に成功した. 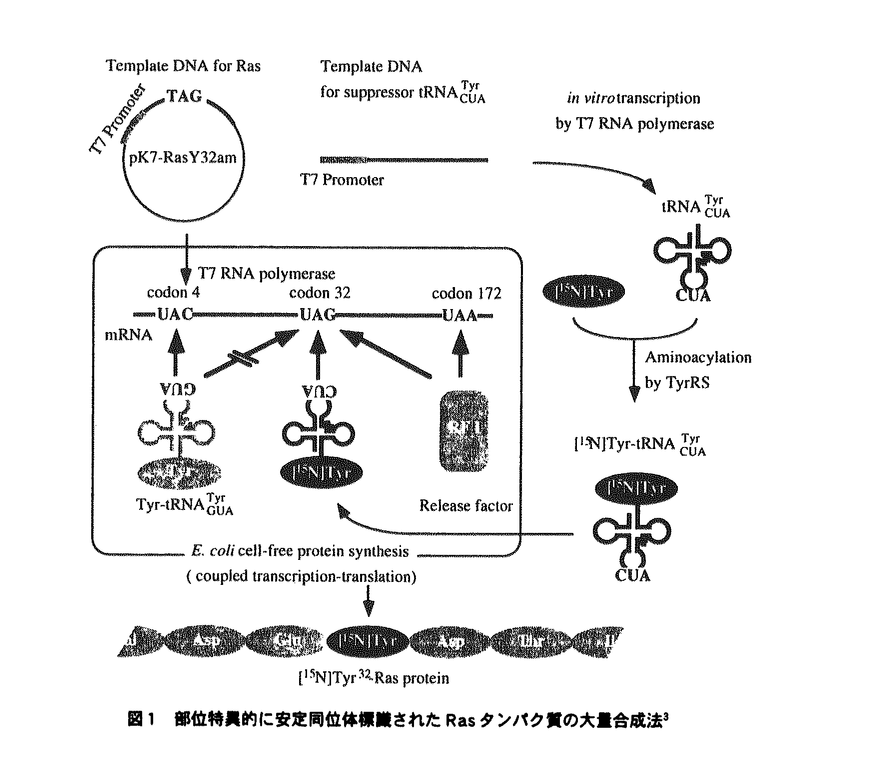 図1部位特異的に安定同位体標識されたRasタンパク質の大量合成法3 図1部位特異的に安定同位体標識されたRasタンパク質の大量合成法3 ユニフォームに15N標識されたRasタンパク質の与えるスペクトル(図2a)と比較して,[15N]Tyr32-Rasタンパク質のスペクトル(図2b)では,Tyr32に対応するピークのみが観測された.他の残基へ標識の漏れは認められず,Tyr32における標識効率も高かったことから,実用的な標識タンパク質が得られたことが明らかとなった.この部位特異的な安定同位体標識法により,NMR法により解析が可能なタンパク質の範囲が飛躍的に広まる.  図2Rasタンパク質の1H-15N HSQCスペクトル(a)uniform[15N]Ras.シグナルの帰属はMuto4,Ito5らによる.(b)[15N]Tyr32-Ras 図2Rasタンパク質の1H-15N HSQCスペクトル(a)uniform[15N]Ras.シグナルの帰属はMuto4,Ito5らによる.(b)[15N]Tyr32-Ras 前述の部位特異的な安定同位体標識法でも示されたように,無細胞タンパク質合成系には,合成系を人為的に変更できる利点がある.この利点ゆえに,無細胞タンパク質合成系には,標識タンパク質の発現にとどまらず,一般的なタンパク質の発現系としての幅広い応用可能性を秘めている.たとえば,生細胞は厳密な生命維持機構をもつため,生育上不要な外来タンパク質を発現させた場合,沈殿,分解などにより排除される傾向がある.しかし,無細胞タンパク質合成系は,適当なシャペロンやプロテアーゼ阻害剤を加えることにより,このようなタンパク質に適した発現系へと改変することができる.また,無細胞タンパク質合成系では,鋳型DNAを投入するだけで目的のタンパク質を含む粗抽出液が得ることができる.生細胞における発現系では必要なトランスフォーメーション,培養,集菌,溶菌といった工程が不要となるため,極めて迅速にタンパク質の発現,精製を行うことができる. このように,無細胞タンパク質合成系には優れた特徴があるにも関わらず,生細胞と比較して極めて低い合成量しか得られないため,タンパク質の発現系として一般的ではなかった. 本研究の第二の目的は無細胞タンパク質合成系の合成量を改善することにより,広く一般的に用いることのできるタンパク質発現系とすることである. 特に,大量のタンパク質を必要とするNMRによる構造機能解析のためのタンパク質発現系としても利用可能とすることを念頭におき,mgオーダーのタンパク質を容易に得ることのできる系とすることを目指した. まず,タンパク質合成に用いる大腸菌粗抽出液の濃縮によりタンパク質合成速度,および,基質あたりの合成量を向上した.また,タンパク質合成に必要とされるアミノ酸,ATP等の基質を透析を用いて供給しながら反応を行う方法(透析法)により,合成時間の大幅な延長を果たした.さらに,これらを組み合わせることにより,試験管内で反応を行う従来の方法(バッチ法)のほぼ10倍の合成量(1mlの反応液あたり3mg以上のCATタンパク質)を達成した(図3a).合成終了時においてCATタンパク質はほとんど分解されておらず,酵素活性も保持していた.また,SDS-PAGEによる解析の結果,CATタンパク質は唯一のメジャーバンドとして観測された(図3b).したがって,タンパク質合成後の精製過程も容易となることが示された.  図3無細胞タンパク質合成系により合成したCATタンパク質(a)合成のタイムコース.バッチ法(×),透析法(■)(b)合成産物のSDS-PAGEによる解析結果 図3無細胞タンパク質合成系により合成したCATタンパク質(a)合成のタイムコース.バッチ法(×),透析法(■)(b)合成産物のSDS-PAGEによる解析結果 本研究により,無細胞タンパク質合成系は一般的なタンパク質発現系として,タンパク質機能構造解析をはじめとしてさまざまな分野で広く用いられるようになるであろう. 1 Netzer et al.(1997)Nature,388,343-3492 Sonar et al.(1994)Nat.Struct.Biol.,1,512-5173 Yabuki et al.(1998)J.Biomol.NMR,in press4 Muto et al.(1993)J.Biomol.NMR,3,165-1845 Ito et al.(1997)Biochemistry,36,9109-9119 |
| 審査要旨 | | 無細胞タンパク質合成系は,細胞抽出液を用いて試験管内でタンパク質合成を行う手法であり,系を容易に変更できるという特徴があるが,タンパク質合成量が少なかった.近年になって合成量が改善され,多量のタンパク質を要する機能,構造解析のためのタンパク質の発現系としての応用が可能となった. 本論文は,無細胞タンパク質合成系のタンパク質の機能・構造解析への応用について述べたものである.NMR法によるタンパク質の機能・構造解析のための新たな手法となる,部位特異的に安定同位体標識されたタンパク質の大量合成法の確立と,多量のタンパク質が必要とされるタンパク質機能・構造解析のためのタンパク質発現系として幅広く応用可能とするための無細胞タンパク質合成系の合成量の改善法について述べられている. 本論文の第2章では,NMR法によるタンパク質の機能・構造解析のための,部位特異的に安定同位体標識されたタンパク質の大量合成法を世界に先駆けて確立している.この方法を用いて,実際にヒトがん遺伝子c-Ha-rasの産物,Rasタンパク質の標識を行い,2.2mgの[15N]Tyr32-Rasタンパク質の合成に成功している.そして,このタンパク質の1H-15N HSQC NMRスペクトルを測定し,合成されたタンパク質の解析を行ない,Tyr32以外の残基への標識の漏れがみられないことが示された.また,Tyr32の安定同位体による標識率の解析を行い,約50%の標識率が得られることが明らかとなった.これらの結果より,NMR法による解析を行う上で実用的な標識タンパク質が得られたことが示された.そして,この方法により,これまでNMR法では解析の困難であった,分子量の大きなタンパク質,および,タンパク質間相互作用のNMR法による解析が可能となり,NMR法を用いて解析可能なタンパク質の範囲が大きく広がると考察している. 本論文の第3章では,無細胞タンパク質合成系のタンパク質合成量の改善法について述べられている.PEGを用いて濃縮した細胞抽出液を反応に用いることで反応速度を向上し,基質を透析膜を介して供給することにより反応時間の延長できることが示された.また,透析膜外部の基質溶液を反応途中で新たなものに交換することにより,反応時間をさらに延長できることが明らかとなった.さらに,これらを組み合わせることにより,従来の方法(バッチ法)と比較してほぼ20倍の合成量(1mlの反応液あたり6mgのCATタンパク質)が得られることが示された.また,合成されたタンパク質は分解されておらず,酵素活性も保持していたことから,タンパク質の生合成法として実用的であることが示された.また,藻由来の安定同位体標識されたアミノ酸混合物を基質として用いることにより,NMR法による解析に有用なユニフォームに安定同位体標識されたタンパク質の合成に応用できることが示された.そして,多量のタンパク質が必要とされる機能構造解析分野をはじめとして,生化学的研究のためのタンパク質の合成法として無細胞タンパク質合成系は幅広く使用できると考察している. 以上の研究において,部位特異的な標識タンパク質の大量合成法の確立,合成されたタンパク質のNMR法による解析,濃縮された細胞抽出液と透析を用いた無細胞タンパク質合成系の確立,および,合成されたタンパク質の生化学的な解析など,すべて論文提出者が主体となって行ったものであり,審査委員会は,本論文提出者が博士(理学)の学位を受ける資格あるものと判定した.なお,本論文の第2章は,東京大学の横山茂之教授,理化学研究所の木川隆則博士,瀧尾擴士博士,堂前直博士,寺田透氏,伊藤隆博士,Cambridge大学のEamest D.Laue博士,Fred Hutchinson Cancer Research CenterのJonathan A.Cooper博士,東京都立大学の甲斐荘正恒教授との共同研究であるが,論文提出者が主体となって分析および検証を行ったもので,論文提出者の寄与が十分であると判断した. |