学位論文要旨
| No | 113296 | |
| 著者(漢字) | 佐々木,成江 | |
| 著者(英字) | Sasaki,Narie | |
| 著者(カナ) | ササキ,ナリエ | |
| 標題(和) | 真生粘菌(Physarum polycephalum)の高次ミトコンドリア核内における染色体機能発現制御の解析 | |
| 標題(洋) | Studies on the Function of Mitochondrial Nuclei in Physarum polycephalum as a Model System of DNA-protein Complex | |
| 報告番号 | 113296 | |
| 報告番号 | 甲13296 | |
| 学位授与日 | 1998.03.30 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(理学) | |
| 学位記番号 | 博理第3442号 | |
| 研究科 | 理学系研究科 | |
| 専攻 | 生物科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | ミトコンドリアは独自の染色体(ミトコンドリアDNA,mtDNA)を持ち、半自律的に増殖する細胞内小器官である(DuPraw 1970)。ミトコンドリアの増殖にともない、mtDNAは複製や転写されるが、こうした機能はタンパク質により高次に組織化されたミトコンドリア核(核様体)という高次構造内で営まれている。近年、ミトコンドリア核は、複数のmtDNA分子からなっていることが様々な生物で明らかになってきた(Miyakawa,1987;Satoh and Kuroiwa,1991)。しかし、それら複数のmtDNA分子の複製や転写がどのようにミトコンドリア核内で制御されているかは明らかではない。 ミトコンドリア核あたりのmtDNA分子数が多い生物の一つとして、真正粘菌Fhysarum polycephalumが挙げられる。真正粘菌のミトコンドリア核の形態は、アメーバ(n)及び変形体(2n)の各時期において数 ミトコンドリア核の構造による複製と転写の制御機構をin vitroで解析するためには、in vivoの構造かつ機能を保持した単離ミトコンドリア核の単離が必要である。変形体をもちいた構造的に無傷なミトコンドリア核の単離は、鈴木ら(1982)によって報告されていた。そこで、変形体のミトコンドリア核内におけるDNA複製様式を解析した。チミジンのアナログであるBrdUを変形体に1時間取り込ませた後、抗BrdU抗体とFITC標識した2次抗体を用いた抗体染色によりDNA合成部位の局在を蛍光顕微鏡で観察した。その結果、DNAの合成部位はミトコンドリア核の長軸方向に沿って数カ所、点状の輝点として観察され(図3)、変形体においても、輝点の数はミトコンドリア核のDNA含量に比例し、mtDNA約10分子につき1個の輝点が検出される計算になった(図4)。以上のことから、変形体においてもMRCを単位とする複製が行われていることがわかった。さらに、変形体のミトコンドリア核に対しても、ミトコンドリア膜と結合するmtDNAの配列(membrane binding region,MBR)をプローブとしてFISH(fluorescence in situ hybridization)を行った。その結果、MBRはミトコンドリア核の長軸方向に沿って数カ所、点状の輝点として観察された(図5)。このことは、MBRはミトコンドリア核内でクラスターをつくっていることを示している。また、そのMBRのクラスター数はミトコンドリア核のDNA量に比例し、mtDNA10分子につき、一個のクラスターが検出される計算になった(図6)。このことは、変形体でもmtDNAが約10分子ごとにクラスターをつくってミトコンドリアの膜系に結合していることを示している。 鈴木らの方法により単離されたミトコンドリア核画分には細胞核の混入がみられた。このことは、今後の生化学的解析に支障をきたす。そこで、パーコールを用いた超遠心によりミトコンドリアを精製した(図7a-e)。単離ミトコンドリア核は、精製されたミトコンドリアを界面活性剤であるNonidet P-40(NP-40)で膜を可溶化することで得られる(図7f-g)。一般に、膜の可溶化の度合いは、界面活性剤と膜成分の量比により変化し、界面活性剤の濃度を固定した場合には膜タンパク質量が高いほど膜は可溶化されなくなる。そこで、NP-40(0.5%)で処理するミトコンドリアの濃度を変化させ、ミトコンドリア核の単離条件を検討した。電子顕微鏡観察により、高濃度のミトコンドリア(4.5 次に単離ミトコンドリア核(A)がin vivoの構造と機能を反映しているかを解析した。対数増殖期と定常期の細胞から単離したミトコンドリア核(A)のDNA合成活性を測定した結果、in vivoと同様に、定常期と比較して対数増殖期の方が約3〜4倍高い活性を示した。また、あらかじめBrdU処理した変形体から単離したミトコンドリア核を抗体染色した結果、単離ミトコンドリア核はMRC構造も保持していた(図11)。また、BrdUTP存在下でDNA合成反応を行わせ抗体染色を行いDNA合成部位を観察したところ、単離ミトコンドリアおよび単離ミトコンドリア核ともに、MRCを単位とするDNA合成を行っていた(図12)。以上のことは、単離ミトコンドリア核(A)はin vivoの構造と機能を反映しており、構造と機能に関するin vitroの解析に適していることを示している。 DNAの高次構造と機能に重要であるミトコンドリアの核タンパク質を同定するために、NaCl処理により単離ミトコンドリア核(A)の高次構造を解体し、その時に機能が変化するか、またその時にどのようなタンパク質が遊離してくるかを解析した。単離ミトコンドリア核は、0.1MのNaCl処理により、平均10分子のmtDNAを含む小塊へと断片化し、0.2Mでは平均4分子のmtDNAを含む小塊へと断片化した(図13)。また、0.5Mでは、DNAの折り畳みがゆるんだ。また、DNA合成活性の低下は0.2Mで、RNA合成活性の低下は0.5Mで見られた。SDS-PAGEで解析した結果、0.2Mでミトコンドリア核の主要構成タンパク質である41kDaが遊離してきた(図14)。サウスウエスタン解析の結果、41kDaタンパク質はDNA結合能を保持していた(図15)。N末端アミノ酸配列及び内部ペプチドマップを作成しC末端側アミノ酸配列を調べた結果、41kDaタンパク質は新規タンパク質であった。41kDaタンパク質の遺伝子を決定するために、アミノ酸配列からdegenerated primerを作製し、total DNAを用いてPCRを行った(図16A)。その結果、617kbpのDNA断片が増幅され、41KDaタンパク質の一部であろう205アミノ酸をコードする領域を推定した(図16B)。アミノ酸配列から41KDaタンパク質はリジンが多く、ホモロジー検索の結果、トリバノゾーマの細胞核ヒストンH1に類似していた。また、増幅してきたDNA断片をプローブにしたサザンハイブリダイゼーションは、41kDaタンパク質の遺伝子がゲノム中に一つ存在することを示唆した。さらに、41kDaタンパク質の抗体を作製しウエスタン解析をした結果、41kDaタンパク質は細胞核にはなく、ミトコンドリア核に多く局在していた(図17)。 1.真正粘菌の変形体においてもミトコンドリア核内でのDNA複製は、約10分子のミトコンドリアDNAからなる高次構造(ミトコンドリアレプリコンクラスター)を単位として行われていた。 2.in vivoの高次構造と機能を反映したミトコンドリア核の単離に成功した。このことは、in vitroでの高次構造と機能との連関の解析を可能にした。 3.単離ミトコンドリア核の構造をを0.2MNaClで解体することにより、ミトコンドリア核内にふくまれる複数のmtDNA分子がバラバラになり、高次構造が崩壊し、DNA合成活性の低下が起こることがわかった。この時に遊離してくるタンパク質を解析し、ミトコンドリア核を構成するメインタンパク質で、DNA結合能があり、ヒストンH1タンパク質に類似した高リジン塩基性タンパク質(41kDa)を同定した。 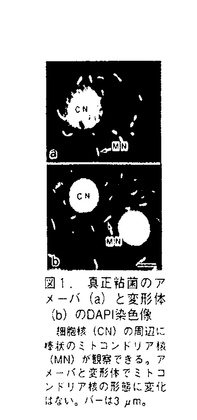 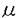 m。 m。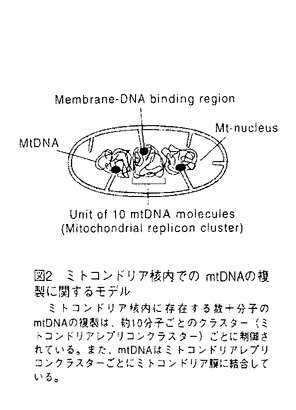  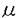 m。 m。  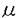 m。 m。  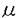 m(a,b,c)と5 m(a,b,c)と5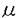 m(d-g)。 m(d-g)。 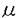 g mitochondrial protein/ g mitochondrial protein/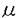 l)を0.5%NP-40で処理したミトコンドリア核(a)と、低濃度のミトコンドリア(0.15 l)を0.5%NP-40で処理したミトコンドリア核(a)と、低濃度のミトコンドリア(0.15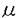 g mitochondrial protein/ g mitochondrial protein/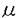 l)を0.5%NP-40で処理したミトコンドリア核(b)をネガティブ染色し、電子顕微鏡で観察した。バーは200nm。 l)を0.5%NP-40で処理したミトコンドリア核(b)をネガティブ染色し、電子顕微鏡で観察した。バーは200nm。   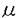 m。 m。 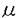 m。 m。     | |
| 審査要旨 | 本論文は3章からなり、第1章では高次ミトコンドリア核内でのDNA合成様式とDNAの配向について、第2章ではin vivoのDNAの高次構造と機能を反映したミトコンドリア核の単離について、第3章ではDNAの高次構造と機能に関与するミトコンドリア核タンパク質の同定について述べられている。 生命の遺伝情報を担うDNAは、生体内ではタンパク質との相互作用により高次に組織化された状態で存在する。ミトコンドリアDNAも生体内ではタンパク質と結合し、コンパクトに組織化されたミトコンドリア核という構造をとっている。しかし、DNAの機能、つまり複製や転写、の制御機構に関する多くの解析は、裸のDNAとタンパク質との相互作用という視点からなされてきた。そこで、論文提出者は、真正粘菌の変形体の高次ミトコンドリア核を用い、高次構造内でのDNAの機能発現制御機構を解析した。 高次ミトコンドリア核内での複製の制御機構を明らかにするために、in vivoでのミトコンドリア核内でのDNA合成様式やDNAの配向を解析することは重要である。第1章では、DNA合成部位と膜結合部位の観察から、(1)真正粘菌の変形体のミトコンドリア核内では約10分子のmtDNA分子(ミトコンドリアレプリコンクラスター)を単位として複製が制御されていること、(2)mtDNAはミトコンドリアレプリコンクラスターごとにミトコンドリア膜に結合していることを示した。これらの結果は、ミトコンドリア核内のDNAの高次構造が複製の制御に重要な役割を果たしていることを示唆している。 高次ミトコンドリア核内での複製の制御機構をin vitroで解析するために、in vivoの高次構造と複製機能を保持したミトコンドリア核の単離は必須である。第2章では、まずパーコールを用いた密度勾配遠心による高純度のミトコンドリア単離法を確立し、その単離ミトコンドリアを界面活性剤であるノニデットP-40で処理して得られた単離ミトコンドリア核が高次構造を保持されていることを示した。また、高濃度の単離ミトコンドリア(4.5mg protein/ml)を0.5%ノニデットP-40で処理して得た単離ミトコンドリア核Aは、低濃度の単離ミトコンドリア(0.15mg protein/ml)を0.5%ノニデットP-40で処理して得た単離ミトコンドリア核Bと比較して、約20倍のミトコンドリアの内膜を含んでおり、ノニデットP-40処理時のミトコンドリア濃度が内膜の可溶化に影響することを明らかにした。さらに、単離ミトコンドリア核Aは(1)単離ミトコンドリア核Bと比較して約5倍のDNA合成活性を保持し、単離ミトコンドリアとほぼ同量のDNA合成活性、DNAポリメラーゼを保持していること、(2)in vivoのミトコンドリアレプリコンクラスターの構造と機能を保持していること、(3)in vivoのDNA合成活性の変化を反映していることを明らかにした。以上の結果は、単離ミトコンドリア核Aの方が単離ミトコンドリアBよりもin vitroでの解析に適していることを示唆している。 高次ミトコンドリア核内での複製の制御機構を明らかにするために、DNAの高次構造や機能に関与するタンパク質を同定することは重要である。第3章では、まずNaCl処理による単離ミトコンドリア核Aの高次構造の崩壊や機能の低下を解析し、(1)0.2M NaCl処理ではミトコンドリアレプリコンクラスター構造の崩壊、DNA合成活性の低下が見られること、(2)0.5M NaCl処理では裸出したDNA構造やのRNA合成活性の低下が見られることを明らかにした。また、その際にミトコンドリア核から可溶化してくるタンパク質を解析し、DNA結合能を保持する56、41、39kDaタンパク質を同定した。さらに、ミトコンドリア核の主要構成タンパク質である41kDaタンパク質のアミノ酸配列を解析し、このタンパク質がヒストンH1に類似した高リジン塩基性タンパク質であることを示した。ヒストンH1タンパク質は、細胞核内においてDNAの高次構造や機能に関わっていることから、41kDaタンパク質も、ミトコンドリア核においてDNAの高次構造や機能に関わっている可能性が考えられる。 こうした一連の解析を通して、論文提出者は常に複数の手法を併用することにより、ミトコンドリア核内のDNAの高次構造が複製の制御に重要な役割を果たしていることを示し、またミトコンドリア核においてDNAの高次構造や機能に関わっているであろう41kDaタンパク質を同定した。さらに、高次構造と機能を反映したin vitro DNA合成系も確立しており、高次構造内での複製の制御機構を解析するための基礎を築いた本論文提出者の業績は優れている。なお、本論文の第1章は、鈴木健史、河野重行両氏と、第2章は酒井敦、河野重行、黒岩晴子、黒岩常祥氏らと、第3章は、西谷千佳子、高野博嘉、河野重行、黒岩常祥氏らとの共同研究であるが、論文提出者が主体となって解析および検証を行ったもので、論文提出者の寄与が十分であると判断する。従って、博士(理学)を授与できると認める。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54623 |