学位論文要旨
| No | 113300 | |
| 著者(漢字) | 日原,由香子 | |
| 著者(英字) | Hihara,Yukako | |
| 著者(カナ) | ヒハラ,ユカコ | |
| 標題(和) | シアノバクテリアの強光順化に関わる遺伝子の単離とその生理学的解析 | |
| 標題(洋) | Molecular cloning and physiological characterization of a gene involved in acclimation to high light in cyanobacteria. | |
| 報告番号 | 113300 | |
| 報告番号 | 甲13300 | |
| 学位授与日 | 1998.03.30 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(理学) | |
| 学位記番号 | 博理第3446号 | |
| 研究科 | 理学系研究科 | |
| 専攻 | 生物科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 光合成生物は刻々と変化する光環境に対して、光合成の効率を最適化し、かつ光阻害を回避するために、自らの光合成系を変えて順応する能力を備えている。具体的には光強度や光質の変化に応じて、集光性アンテナのサイズを変える、二つの光化学系の量比を変える等の調節を行うことが、様々な生物種における生理学的研究の蓄積により明らかにされてきた。しかし、それらの調節の遺伝子レベルでの解明は、ほとんどなされていないのが現状である。本研究では、酸素発生型光合成を行い形質転換が容易な単細胞性シアノバクテリア、Synechocystis sp.PCC 6803から光順化変異株を単離し、変異遺伝子の同定を行った。またその表現型の解析を行うことにより、変異遺伝子が強光下での光化学系量比の調節に関与していることを明らかにした。さらにその変異株が光独立栄養条件下で野生株を完全に駆逐してしまったという研究室内小進化とも言うべき事実を見出した。 当研究室では、Synechocystis sp.PCC 6803のグルコース耐性株であるWilliams株を用いて実験を行っているが、私は遺伝的に均一だと思われていたこの野生株が、光独立栄養条件、特に強光下でコロニーサイズの異なった二集団に分けられることを見出した。すなわち光独立栄養条件での生育は遅いが培地にグルコースを加えた光混合栄養条件下では良く生育するタイプ(WS株)と、光独立栄養条件での生育は良いが、光混合栄養条件下では厳しい生育阻害を受けるタイプ(WL株)である(図1)。これは二者間で、光順化に関する何らかの因子が異なっていることを意味する。そこでWL株の光混合栄養条件下での生育能を相補するゲノム断片を単離同定したところ、新規遺伝子の一塩基の違いがこのような表現型の違いを引き起こしていることが明らかになり、この遺伝子をpmgA(photomixotrophic growth)と名付けた(図2)。pmgAは204アミノ酸からなる23kDaのタンパクをコードしており、そのアミノ酸配列には既知の配列との高い相同性は認められなかったが、システイン残基が多いこと、二成分調節系のセンサータンパク質のG1,G2ボックスと相同性があるドメインを持つという特徴があった。pmgAの193番塩基はWS株ではシトシン、WL株ではチミンであり、それに従い翻訳産物の65番目のアミノ酸残基がそれぞれロイシン、フェニルアラニンとなっていた。これら2つの遺伝子型のどちらが正常な遺伝子産物をコードしているのか知るために、pmgAにスペクチノマイシン耐性カセットを挿入し遺伝子破壊株を作成した。この株はWL型とよく似た表現型を示し(図1)、正常なpmgA産物を持つのはWS型(以後野生株と呼ぶ)であることが明らかになった。pmgAには前後に近接したORFが存在しており、上流のORFは出芽酵母のエンド-エキソヌクレアーゼと相同性のある463アミノ酸からなるタンパクを、下流のORFは176アミノ酸からなる未知のタンパクをコードしていた。これらのORFの破壊も行ったが、破壊株の表現型は野生株に似ており、これらのORFがpmgAとは独立に機能していることが示唆された。以上の結果より、当研究室で維持している野生株中に、pmgA遺伝子中の一塩基の違いにより、光独立栄養条件で有利なタイプと光混合栄養条件で有利なタイプの二種類が生じていることが明らかになった。   Em-2s-1)で4日間(A、B、C)、強光(370 Em-2s-1)で4日間(A、B、C)、強光(370 Em-2s-1)で3日間(D、E、F)、グルコース添加培地(50 Em-2s-1)で3日間(D、E、F)、グルコース添加培地(50 Em-2s-1)で5日間(G、H、I)それぞれ培養した。 Em-2s-1)で5日間(G、H、I)それぞれ培養した。 次にpmgA変異株(WL株、遺伝子破壊株)の表現型をさらに詳細に調べた。まず、強光培養時の細胞の吸収スペクトルが、野生株とpmgA変異株で異なっていることを見出した。弱光条件下では全ての株が同様なスペクトルを示したが、強光条件下では620nmのフィコシアニンの吸収極大に対する678nmのクロロフィルaの吸収極大の相対比が野生株とpmgA変異株で異なっていた。そこで細胞当たりの色素含量を吸収スペクトルのピークの高さから算出し、弱光培養株を強光条件下に移したときの色素量変化を調べた。フィコシアニン、クロロフィルaとも強光条件で減少するのはすべての株に共通しているが、フィコシアニン量の変動は各株の間でそれほど違いがなく、pmgAの有無に影響されていなかった(図3B)。それに対し、クロロフィルaの変動には野生株とpmgA変異株で明らかな違いがみられる(図3A)。これは、強光シフト後6時間以降のクロロフィルaの蓄積量が、pmgA変異株でWS株を上回ることが原因であると考えられる。シアノバクテリアはアンテナクロロフィルタンパクを持たないため、クロロフィルa量の違いは反応中心量の違いを反映している可能性がある。そこで、77Kでの蛍光スペクトルを測定した。この方法では695nm付近をピークとする系II蛍光(F695)と725nm付近をピークとする系I蛍光(F725)の大きさを比べることにより、光化学系の量比を大まかに知ることができる。弱光と強光でのスペクトルを比較すると、野生株では弱光条件に比べ強光条件で系IIの割合が相対的に大きく増加していた。pmgA変異株ではその増加はわずかであった(図4A)。図6と同じ条件でF695/F725比の時間変化をプロットすると(図4B)、野生株では強光シフト後12時間ほどで光化学系量比の変動が顕著になるのに対し、pmgA変異株では強光培養の全期間を通じてほとんど変動が起きていなかった。この事実は、光化学反応中心の直接的な定量(系II:チトクロムb559量/2、系I:P700量)でも確認された(表1)。これまでに高等植物、緑藻、シアノバクテリア等で、強光条件下で光化学系Iが相対的に減少することが報告されているが、その分子機構は未だ全く解明されていなかった。以上の結果はpmgAがこの調節に特異的に関わっていることを強く示唆する。   Em-2s-1)から強光(200 Em-2s-1)から強光(200 Em-2s-1)に移した際の色素含量変化 Em-2s-1)に移した際の色素含量変化  Em-2s-1)の場合を点線で、強光(200 Em-2s-1)の場合を点線で、強光(200 Em-2s-1)の場合を実線で示した。スペクトルは725nmでノーマライズした。(B)弱光(20 Em-2s-1)の場合を実線で示した。スペクトルは725nmでノーマライズした。(B)弱光(20 Em-2s-1)から強光(200 Em-2s-1)から強光(200 Em-2s-1)に移した際のF695/F725の変化。●:WS、○:WL、□:pmgA破壊株を示す。横軸は弱光培養株を植えつぎ、強光下に移してからの時間を示す。 Em-2s-1)に移した際のF695/F725の変化。●:WS、○:WL、□:pmgA破壊株を示す。横軸は弱光培養株を植えつぎ、強光下に移してからの時間を示す。次に弱光と強光での培養株の、炭酸固定を含めた光合成活性と光化学系の個別の電子伝達活性を飽和光下で測定した。一般に強光条件では、細胞当たりの炭酸固定活性はRuBPカルボキシラーゼの量や活性が増えるため増加し、光化学反応の活性は反応中心自体の量が減るため減少する。今回の測定でもその傾向はpmgAの有無に関わらず表れており、pmgAは特に炭酸固定系の光による増強には関与していなかった。さらに、強光培養株の活性を比較すると、全光合成、系II、系Iの全てでpmgA変異株の活性が野生株の活性を上回っており、このことが強光下でのpmgA変異株の増殖の速さの一因と考えられる。 さらにRT-PCR法により、強光シフト後のpmgA転写産物の発現誘導を調べた(図5)。pmgA転写産物は弱光下でもわずかに発現しているが、強光シフト後4時間目に光化学系量比の変動に先だって大きく誘導されることが示された。   Em-2s-1)から強光(200 Em-2s-1)から強光(200 Em-2s-1)に移した際の細胞当たり光化学系量、光化学系量比の変化 Em-2s-1)に移した際の細胞当たり光化学系量、光化学系量比の変化  Em-2s-1)から強光(200 Em-2s-1)から強光(200 Em-2s-1)に移した時間を0hとした。中段はポジティブコントロール、下段は逆転写前のRNAを鋳型に用いたネガティブコントロール。 Em-2s-1)に移した時間を0hとした。中段はポジティブコントロール、下段は逆転写前のRNAを鋳型に用いたネガティブコントロール。 1章で示したように、pmgA変異株は研究室の野生株中にかなりの割合で存在していた。このことは、pmgAを介する順化機構が必須ではないことを意味するのだろうか?そこでまずこのような多型がいつ現れたのか知るために、過去に研究室で凍結保存していた野生株を分析した。ゲノムDNAを単離してpmgAをPCR増幅し、それを鋳型として用いるダイレクトシーケンス法と、強光下でのコロニーサイズを調べる方法を併用して多型の検出を行った。その結果、1995年6月以前に野生株からpmgAの一塩基変異株(WL株)が生じ、驚いたことに一年ほどの間に研究室の野生株を完全に駆逐してしまったという事実が明らかになった(図6)。次にpmgA遺伝子を持つことが、いかなる場合に有利または不利になるのかを様々な培養条件下で調べた。まず等量の野生株とWL株を混合し、200   Em-2s-1で3日間行った。1996年3月のサンプルはDNAのみの保存。 Em-2s-1で3日間行った。1996年3月のサンプルはDNAのみの保存。 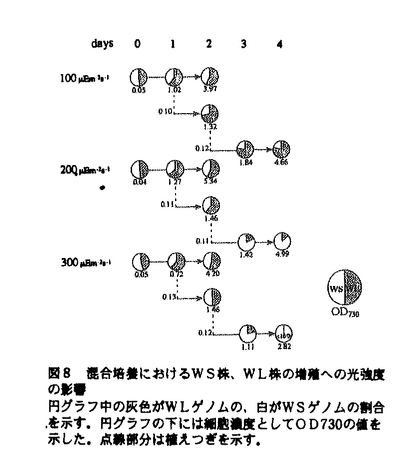 本研究では、強光条件への順化応答に特異的に関わる世界で初めての因子としてpmgAを同定した。pmgAを介する調節機構により、Synechocystis sp.PCC 6803は強光条件下でクロロフィルa含量を減らし、さらに光化学系I量を相対的に減少させることにより強光ストレス(おそらく系I還元側での活性酸素生成による酸化的ストレス)を回避していると考えられる。さらにpmgAの一塩基置換により、容易に野生株を駆逐し得る変異株が出現したことを見出した。このことは環境順化に関わる遺伝子が、研究室内での長期間の培養で容易に失われ得ることを示唆しており、生物の環境適応の柔軟さが伺われる反面、順化応答に関する研究を行うことの困難さを考えさせられる。今後はpmgAの機能をより具体的に追求し、その上流下流で働く因子を同定することにより、強光条件下での光化学系量比調節の分子機構を明らかにしていきたい。また、光強度の場合と同様に光化学系量比の変動が起きることが知られている光質の変化に対して、pmgAを介した調節機構が働いているか否かも興味深い問題である。 | |
| 審査要旨 | 本論文「Molecular cloning and physiological characterization of a gene involved in acclimation to high light in cyanobacteria(シアノバクテリアの強光順化に関わる遺伝子の単離とその生理学的解析)」は3章からなっている。第1章では、強光下で光合成による生育を抑えている新規遺伝子(pmgA)を光合成原核生物であるシアノバクテリアの変異体の解析から単離同定している。第2章では、変異体の強光下での光合成機能を解析して、このpmgA遺伝子が強光に応答して調節している標的が、光化学系Iの蓄積量であり、光化学系II/系Iの比であることを示している。第3章では、このようなpmgA遺伝子が調節している強光応答の生理的意義を、さまざまな培養条件で比較することによって、明らかにしている。また、pmgA変異株が研究室の野生株の過去の培養において優占したという進化的な事実を実証するとともにpmgAが関与している光化学系II/系Iの比の調節の生理的役割の新しい仮説を提出している。本研究は、光合成機能の環境順化に関わる新規遺伝子を単離し、その働きと、生理的意義、進化的意義を明らかにしており、きわめてユニークで、この研究分野での先駆けとなる重要なものである。 第1章では、まずSynechocystisの野生株の中から強光下でよく増殖する系統(WLと命名)と増殖が遅い系統(WSと命名)を分離し、プレートでの増殖特性を解析した。WL系統はグルコース存在下の光混合栄養条件では厳しい生育阻害を受けていたので、この条件下で遺伝的相補により変異部位を同定した。この変異は新規のタンパク質をコードしていると思われるORF204の内部の1塩基の置換で、これによりアミノ酸残基の置換が起こっていた。変異部位を含む遺伝子を破壊した変異体を作製し、その表現型がWL系統と同じであったことから、この遺伝子は本来は光混合栄養条件下での生育に必須なもので、その変異によって機能を失うと光合成的に強光下でよく増殖することが明らかになった。このため、遺伝子をpmgAと命名した。なお、遺伝的変異により光合成増殖が強化されるという変異形質は、これまで例がない非常に特異なものである。 第2章では、変異体の強光下での光合成機能を解析して、強光下でクロロフィル含量が野生株より高いことを見いだした。クロロフィルの低温螢光スペクトルから、野生株が強光下で示す光化学系II/系Iの比の変動をpmgA変異株は示さないことが推測された。さらに、チトクロムb559と系Iの反応中心のP700の量を定量し、変異株ではこの量比の変動がないことを確定した。細胞あたりの光化学系の含量を野生株とpmgA変異株で比較することにより、野生株が強光下で示す光化学系II/系Iの比の変動はおもに光化学系I含量の調節によること、pmgA変異株ではこの調節だけが起こらないことが明らかになった。つまり、pmgA遺伝子は強光下で光化学系I複合体の蓄積を調節することによって、光化学系II/系Iの比を特異的に調節している。これらの細胞の光合成活性を測定し、pmgA変異株は強光下で光化学系IIも系Iもともに高く、炭酸ガスの固定活性も高いことが明らかになった。この高い活性が、pmgA変異株が強光下でよく増殖する原因と結論された。 第3章では、このようなpmgA遺伝子が関与する強光応答の生理的意義を、さまざまな条件での増殖速度の比較によって、明らかにしている。野生株とpmgA変異株を混合して液体培養し、単離したDNAのpmgA遺伝子の塩基配列を直接決定し、細胞比を求めた。その結果、液体培地でも光独立栄養条件下でpmgA変異株が野生株よりもよく生育できること、グルコース存在下では逆にすぐに駆逐されることが示された。実際、過去に凍結保存してあった野生株を再培養して解析したところ、突然出現したpmgA変異株が1年ほどの間に完全に優占したことが明らかになった。おもに光独立栄養的に培養維持している研究室の条件では、有利なpmgA変異株が突然変異によって出現し、本来の野生株を必然的に駆逐したと考えられる。これは、研究室の培養条件へのSynechocystisの適応進化ともいえる現象で、本研究によって遺伝子の変異と機能の変異と適応進化が直接結びつけられた。さらに、連続した光ストレスの下ではpmgA変異株の生存率が急激に低下することを見いだし、光化学系II/系I比の調節が有害な光傷害を避けるための順化であることを示した。つまり、強光ストレス下で野生株のpmgA遺伝子は光化学系Iの蓄積を減らし、相対的に光化学系IIが多くなるため系IIが光阻害を受ける。この阻害によって、系IIは電子伝達全体の流れを絞る調節を行い、過剰な電子供給による活性酸素の発生を抑えている。また損傷を受けた系IIタンパク質は代謝回転によって回復する。一方、pmgA変異株では、相対的に多い光化学系Iが系IIの電子受容部位から電子を奪うため、系IIの光阻害は抑えられ、全体の電子伝達活性は高く保たれ、短期的には光合成増殖が野生株より速くなると考えた。しかし、系Iの電子受容部位に還元力が蓄積すると、活性酸素を生じるため長期的な強光環境では損傷を受けると提唱している。このような新しい作業仮説を実証的な根拠を元に提出し、光合成機能の調節を光合成能力と長期的なストレス耐性まで広げて植物機能の環境応答を解析できることを示した点に本研究の普遍的な意義がある。 なお、本論文の第1章と第3章は池内昌彦との共同研究であり、第2章は園池公毅、池内昌彦との共同研究であるが、論文提出者が主体となって分析および検証を行ったもので、論文提出者の寄与が十分であると判断する。 したがって、博士(理学)の学位を授与できると認める。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54624 |