結果と考察1、温度感受性rsp5-101変異株の表現型とRsp5の局在 Rsp5は分子量92kDaの蛋白質でN末にC2 domain、中程にWW domainを3つ、C末に hect domainという構造を持つ(図1)。C2 domainはCa2依存的に膜に結合する領域として、またWW domainは2つの保存されたトリプトファン残基を持ち、PY motif(XPPXY)と結合し蛋白質間の相互作用に働いていると考えられている。Rsp5はいくつかの膜蛋白質をユビキチン化し、それらのエンドサイトーシスに関わっていることが示されている。エンドサイトーシスされた膜蛋白質はエンドソームと呼ばれる器官を経由して液胞へ到達し分解されると考えられている。
Rsp5の局在を9個のmyc tagをRsp5のORF内に導入したmyc9-Rsp5を作製しmyc抗体を用いて間接蛍光抗体法で観察した。その結果、myc9-Rsp5は主に細胞膜および液胞に局在した(図2)。Rsp5が膜蛋白質のエンドサイトーシスに関与していることを支持する結果といえる。しかし、温度感受性rsp5-101変異株では制限温度下でもルシファイエローのエンドサイトーシスに異常は見られなかった。
ゴルジ体から液胞への物質輸送にもエンドソームを経由する経路がある。rsp5変異株が小胞体から液胞への物質輸送に欠損を持つかどうかをカルボキシペプチダーゼY(CPY)の成熟を指標として調べた。その結果、2種のrsp5変異株のどちらにおいてもCPYの成熟型が観察され、小胞体から液胞への輸送に欠損は持たないと考えられた。しかし、面白いことにむしろ野生型株よりも早く成熟型が観察されるという表現型が観察された(図3)。
またrsp5-101変異株は1 g/mlのカナバニンに感受性をを示した(図4)。カナバニンはアルギニンのアナログで、蛋白質内に取り込まれ異常蛋白質を作ると考えられている。さらにrsp5-101変異株は制限温度下で溶菌するという表現型も持つ。これよりRsp5はストレス負荷応答、異常蛋白質の分解にも関与していることが予想された。
g/mlのカナバニンに感受性をを示した(図4)。カナバニンはアルギニンのアナログで、蛋白質内に取り込まれ異常蛋白質を作ると考えられている。さらにrsp5-101変異株は制限温度下で溶菌するという表現型も持つ。これよりRsp5はストレス負荷応答、異常蛋白質の分解にも関与していることが予想された。
2、rsp5-101変異を多コピーで抑圧する遺伝子の単離 rsp5-101変異株の温度感受性を多コピーで抑圧する遺伝子としてユビキチンをコードするUBl1とUBl4のほかに、新たにAST1,WHI2を単離した(図5)。
AST1は細胞膜蛋白質pma1の温度感受性変異を多コピーで抑圧する遺伝子として単離されていた。誤って液胞に運ばれる変異pma1をAst1は細胞膜へ正しく局在させる活性を持つと考えられている。
whi2変異株は定常期に入れず細胞の大きさを小さくしながら増殖し続ける株として単離されていた。多コピーのWHI2はユビキチンをコードするUB14遺伝子の発現を上昇させることがわかった。このことがWhi2によりrsp5-101変異が抑圧される理由のひとつとして考えられる。Whi2がRSP5の転写量を増やす、蛋白質を安定化させるなど直接rsp5-101変異を抑圧している可能性や、細胞内の状態を大きく変えることで他の分解系を活性化し抑圧している可能性なども、その他考えられる。Whi2に依る抑圧をさらに解析するためにWhi2と結合するYll010Cをtwo-hybrid法で単離した。またYll010Cと相同性を示すYlr019Wも単離した。これらはどちらもWhi2と同じく多コピーでrsp5-101変異を抑圧した。
Yll010C、Ylr019Wには分裂酵母、ヒト、線虫に相同産物と思われるものが存在し(図6)、Whi2-Yll010C複合体による細胞増殖の制御は真核生物において保存されている可能性がある。
3、Rsp5の結合因子Bul1,2の解析 two-hybrid systemでBul1はRsp5と複合体を形成していることが予想された。HA tagを2つ付けたBul1HA2とN末にmyctagを付けたNmycRsp5を作製しショ糖密度勾配遠心でBul1とRsp5がどのような大きさの複合体を形成しているのか調べた(図7)。その結果、Bul1、Rsp5はどちらも40S、もしくは22Sという沈降係数を持つ画分に分離された。また40Sの画分を用いて免疫沈降実験を行いRsp5とBul1がin vivoで複合体を形成していることを確認した。
次にRsp5と複合体を形成する新規の因子Bul2を同定した。BUL2はBUL1と同じ13番染色体に存在し、Bul1と50%同一なアミノ酸配列を持つ。Bul2とRsp5が複合体を形成することはtwo-hybrid法で碓認した。 bul1
bul1 bul2 2重破壊株は温度感受性の増殖を示した。さらにNa+、Li+感受性、またグリセロール培地で生えないなどの表現型を示した(図8)。このことからBul蛋白質は通常の増殖に必須ではないが、細胞にとって好ましくない環境、もしくは環境の変化に応答するために必要であることが予想される。
bul2 2重破壊株は温度感受性の増殖を示した。さらにNa+、Li+感受性、またグリセロール培地で生えないなどの表現型を示した(図8)。このことからBul蛋白質は通常の増殖に必須ではないが、細胞にとって好ましくない環境、もしくは環境の変化に応答するために必要であることが予想される。
Bul1とBul2はともにRsp5のWW domainと相互作用すると思われるPY motifを1つ持つ。PY motifに変異を導入して、Bul1とRsp5との複合体形成能の変化をtwo-hybrid法で調べた。その結果,複合体形成能は10分の1程度に下がりPY motifとWW domainがBul1とRsp5の複合体形成に必要であることがわかった(図9)。PY motifに変異を持つbul1は蛋白質としては安定であるが、 bul1
bul1 bul2株の温度感受性を相補できなかった(図9)。これよりBul1はRsp5と結合しないと機能を持たないことが示唆される。
bul2株の温度感受性を相補できなかった(図9)。これよりBul1はRsp5と結合しないと機能を持たないことが示唆される。
さらにBul1がRsp5とユビキチン化される基質として複合体を作っているのかどうかを調べた。もしBul1がRsp5でユビキチン化され分解される基質なら野生型株内でより、rsp5-101変異株内で分解されず安定となると考えられる。しかし、pulse-chase実験でBul1の安定性を調べた結果、rsp5-101変異株内と野生型株内とで経時的な量の変化は見られなかった(図10)。これよりBul1はRsp5にユビキチン化される基質ではないと考えられる。
最後にBul1HA2の局在をHA抗体を用い間接蛍光抗体法で観察した。Bul1HA2は細胞質全体に存在した(図11)。このことから、Bul1は細胞膜以外に存在する、Rsp5の基質のユビキチン化に関わっている可能性が考えられる。
まとめ 1)Rsp5ユビキチンリガーゼは、主に細胞膜上および液胞に存在した。小胞体から液胞への輸送に欠損を持つかどうかを2種類のrsp5変異株を用いて調べた。どちらにおいても成熟型のCPYが観察され、輸送に欠損は見られなかった。むしろ、逆に野生型株より早く成熟型が観察された。カナバニンに感受性を示すことから、異常蛋白質の分解にRsp5が必要であることがわかった。
2)rsp5-101変異株の温度感受性を多コピーで抑圧する遺伝子としてAST1、WHI2を単離した。WHI2の関連遺伝子としてtwo-hybrid systemでYLL010Cを得、さらに、その相同遺伝子YLR019Wを単離した。両遺伝子はともにrsp5-101変異を多コピーで抑圧した。
3)Rsp5ユビキチンリガーゼに結合する因子としてBul1、Bul2を単離した。Bul1、Bul2はRsp5にユビキチン化される基質としてではなく結合し、何らかの形でRsp5を制御していると考えられる。ヒトE6-APがウイルスのE6と結合すると初めてp53を認識しユビキチン化するように、Bul1、Bul2もRsp5に対し、基質特異性を与えているのかもしれない。Bul1、Bul2は増殖に必須ではないが bul1
bul1 bul2遺伝子破壊株が高温感受性や高濃度の塩感受性を示す。このことからBul蛋白質が認識する基質は、特殊な環境において、もしくは環境の変化に応答するために分解される必要性があるものである可能性がある。
bul2遺伝子破壊株が高温感受性や高濃度の塩感受性を示す。このことからBul蛋白質が認識する基質は、特殊な環境において、もしくは環境の変化に応答するために分解される必要性があるものである可能性がある。
 図1 出芽酵母Rsp5ユビキチンリガーゼの構造C2 domainはCa3+依存的に膜に結合し、WW domainはPY motifと結合して蛋白質間の相互作用に働いていると考えられている。nect domainはユビキチンリガーゼとしての活性を担う領域である。
図1 出芽酵母Rsp5ユビキチンリガーゼの構造C2 domainはCa3+依存的に膜に結合し、WW domainはPY motifと結合して蛋白質間の相互作用に働いていると考えられている。nect domainはユビキチンリガーゼとしての活性を担う領域である。 図2 myc9-Rsp5の細胞内局在の観察rsp5-101変異株でmyc tagを9個つけたmyc9-Rsp5を発現させ、間接蛍光抗体法により細胞内での局在を観察した。
図2 myc9-Rsp5の細胞内局在の観察rsp5-101変異株でmyc tagを9個つけたmyc9-Rsp5を発現させ、間接蛍光抗体法により細胞内での局在を観察した。 図3 rsp5変異株内でCPYの輸送パルスチェイス法でCPYの輸送を観察した。ラベルしたメチオニンを26℃で10minとりこませ、lane1〜6はそのままlane7〜12は37℃でチェイスを行った。lane1.2.7.8は野生型株。lane3.4.9.10はrsp5-101。lane5.6.11.12はrsp5-uby.奇数laneはchase線 0min、過数laneはchase後30minのサンプルである。P1は小胞体型、P2はゴルジ体型、mは成熟型のCPYをしめす。
図3 rsp5変異株内でCPYの輸送パルスチェイス法でCPYの輸送を観察した。ラベルしたメチオニンを26℃で10minとりこませ、lane1〜6はそのままlane7〜12は37℃でチェイスを行った。lane1.2.7.8は野生型株。lane3.4.9.10はrsp5-101。lane5.6.11.12はrsp5-uby.奇数laneはchase線 0min、過数laneはchase後30minのサンプルである。P1は小胞体型、P2はゴルジ体型、mは成熟型のCPYをしめす。 図4 rsp5-101変異株のカナバニン感受性カナバニンはアルギニンのアナロングで異常蛋白質を作ると考えられている。25℃で2日培養した。
図4 rsp5-101変異株のカナバニン感受性カナバニンはアルギニンのアナロングで異常蛋白質を作ると考えられている。25℃で2日培養した。 図5 rps5-101変異の多コピー抑圧遺伝子rsp5-101変異株にvector、RSP5、WHI2、AST1をそれぞれ多コピーで場入しYPD培地で35.5℃、3日培養した。
図5 rps5-101変異の多コピー抑圧遺伝子rsp5-101変異株にvector、RSP5、WHI2、AST1をそれぞれ多コピーで場入しYPD培地で35.5℃、3日培養した。 図6 さまざまな真核生物に存在するYLL010C,YLR019Wの相同産物YA22は分裂酵母、HYA22はヒト、F45E12.1とB0379.4は線虫の蛋白質である。全てに共通するアミノ酸の下にアスタリスクをつけた。
図6 さまざまな真核生物に存在するYLL010C,YLR019Wの相同産物YA22は分裂酵母、HYA22はヒト、F45E12.1とB0379.4は線虫の蛋白質である。全てに共通するアミノ酸の下にアスタリスクをつけた。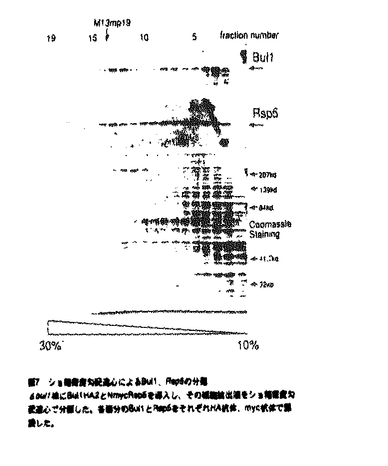 図7 ショ糖密度勾配遠心によるBul1、Rsp5の分画
図7 ショ糖密度勾配遠心によるBul1、Rsp5の分画 bul1株にBul1HA2とNmycRsp5を導入し、その細胞抽出液をショ糖密度勾配遠心で分画した。各画分のBul1とRsp5をそれぞれHA抗体、myc抗体で認識した。
bul1株にBul1HA2とNmycRsp5を導入し、その細胞抽出液をショ糖密度勾配遠心で分画した。各画分のBul1とRsp5をそれぞれHA抗体、myc抗体で認識した。 図8
図8  bul1
bul1 bul2変異株の表現型A;WT,B;
bul2変異株の表現型A;WT,B; bul1
bul1 bul2,C;
bul2,C; bul2,D;
bul2,D; bul1
bul1 図9 Bul1のPY motifへの変異導入Bul1がもつPY motifのPPSYをOASYに変えたBul1P137GP138Aを作製しtwo-hybrid法でRsp5との結合能の変化を
図9 Bul1のPY motifへの変異導入Bul1がもつPY motifのPPSYをOASYに変えたBul1P137GP138Aを作製しtwo-hybrid法でRsp5との結合能の変化を ガラクトシダーゼの活性を指標として調べた。またBul1P137GP138Aが
ガラクトシダーゼの活性を指標として調べた。またBul1P137GP138Aが bul1
bul1 bul2株の温度感受性を相補できるかどうか調べた。
bul2株の温度感受性を相補できるかどうか調べた。 図10 野生型株内とrsp5-101株内でのBul1の安定性の観察野生型株とrsp5-101株にBul1HA2を導入しバルスチェイスした後、免疫沈降させBul1の安定性を観察した。lane2-6がrsp5-101、lane7-11が野生型株でlane1はBul1HA2を持たないコントロール株である。ラベルしたメチオニンを26℃で20minとりこませ。その後制限温度の37℃でchaseした。chaseの時間はlane2,7が0min,lane3.8が30min、lane4.9が60min、lane5、10が90min、lane6.11が120minである。
図10 野生型株内とrsp5-101株内でのBul1の安定性の観察野生型株とrsp5-101株にBul1HA2を導入しバルスチェイスした後、免疫沈降させBul1の安定性を観察した。lane2-6がrsp5-101、lane7-11が野生型株でlane1はBul1HA2を持たないコントロール株である。ラベルしたメチオニンを26℃で20minとりこませ。その後制限温度の37℃でchaseした。chaseの時間はlane2,7が0min,lane3.8が30min、lane4.9が60min、lane5、10が90min、lane6.11が120minである。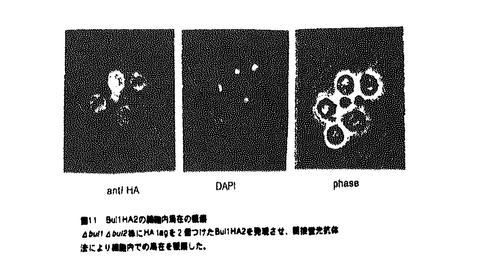 図11 Bul1HA2の細胞内局在の観察
図11 Bul1HA2の細胞内局在の観察 bul1
bul1 bul2株にHAtagを2個つけたBul1HA2を発現させ、間接蛍光抗体法により細胞内での局在を観察した。
bul2株にHAtagを2個つけたBul1HA2を発現させ、間接蛍光抗体法により細胞内での局在を観察した。