| 内容要旨 | | 1.緒言 ヘテロポリ酸の酸化力と酸性質はアニオンの構成元素とカチオンの種類により変化する。バナジウムを含む混合配位ヘテロポリ酸は,高い酸化力を生かして種々の酸化反応に使用されている。本研究では,バナジウムを含む各種の混合配位ヘテロポリ酸(H3+nPMo12-nVnO40,n=1-4)の酸化力を比較するとともに,これらを触媒としてベンゼンなどの選択的酸化反応を行った。さらに,ヘテロポリ酸触媒活性の比較,温度依存性,過酸化水素濃度依存性などの検討を行うことによって,反応条件の最適化を行うとともに本触媒系の特徴を明らかにすることを試みた。 2.実験 各ヘテロポリ酸(H3+nPMo12-nVnO40およびH4+nSiMo12-nVnO40はそれぞれPMo12-nVn,SiMo12-nVnと略す)の酸化力はポーラログラフ,ボルタモグラムを用いて測定した(電極:Glassy-carbon,Ag/AgCl,Pt)。芳香族の過酸化水素による酸化反応は,冷却管,温度計,サンプリング部と過酸化水素注入部(速度論的測定には1mLの注射器を用い,その他の場合は滴下漏斗を用いた)を備えた四ツ口フラスコを用いて行った。触媒,基質及び溶媒を加えたフラスコを油浴に浸し,所定温度に達したのち,過酸化水素を加え反応を開始した。生成物の定量分析は液体クロマトグラフで行った。フェノール収率はとくにことわらない限り,添加した過酸化水素を基準として計算した。過酸化水素の分解反応は分解生成した気体(酸素)の体積を反応管を通じて連結したU字型量気管により測定して追跡した。 3.結果と考察3.1バナジウムを含むヘテロポリ化合物の酸化力1,2) バナジウムを含むヘテロポリ化合物の酸化力(ポーラログラフの第1還元ステップのE1/2)はヘテロポリアニオンの負電荷との関係をFig.1に示す。PMo12,SiMo12いずれのヘテロポリアニオンでもMo6+の一部をV5+に置換すると酸化力が増大した。V5+置換量をさらに増加するとヘテロポリアニオンの酸化力はわずかに低下した。以下,高い酸化力を持つバナドモリブドリン酸を触媒として芳香族化合物の選択的酸化反応を行った。 3.2過酸化水素による芳香族の選択的酸化反応3.2.1ベンゼンの酸化反応4-6) (1)反応条件の最適化 65℃におけるPMo12-nVn(n=0-4)によるベンゼンの酸化反応の経時変化をFig.2aに示す。PMo12-nVn(n=2-4)ではフェノールは速やかに生成し,反応開始約10分でその収率は最大となった。一方,PMo11Vでは長い誘導期が見られた。最大のフェノール収率はPMo12-nVn(n=1-4)でそれぞれ30%(反応したベンゼンを基準にした選択性:94%),37%(93%),36%(100%),34%(95%)で,PMo9V3,PMo10V2で最大となった。H3+nPVnMo12nO40(n=2,4)の場合,さらに反応を続けるとフェノール収率がやや減少した。これはおもにフェノールの逐次酸化が進行しヒドロキノンが生成したためである。 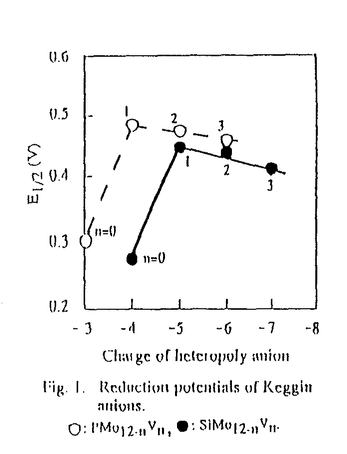 Fig.1. Reduction potentials of Keggin anions Fig.1. Reduction potentials of Keggin anions  Fig.2.Oxidntion of benzene with hydrogen peroxide catalyzed by H3+nPMo12-nVnO40(n=O-4)as a function of time.(a):Formation of phenol as a function of time.(b)):Formation of oxygen as a function of time.Catalyst:0.3 mmol,H2O:25mL,C6H6:10mL(112mmol),H2O2:0.8mmol(32mM in H2O),reaction temperature:65℃.Phenol:△:PMo11V,●:PMo10V2,○:PMo9V3,▲:PMo8V4,□:PMo12.Hydroquinone:◆:PMo8V4,◇:PMo10V2.Hydrogen peroxide was added in a single step. Fig.2.Oxidntion of benzene with hydrogen peroxide catalyzed by H3+nPMo12-nVnO40(n=O-4)as a function of time.(a):Formation of phenol as a function of time.(b)):Formation of oxygen as a function of time.Catalyst:0.3 mmol,H2O:25mL,C6H6:10mL(112mmol),H2O2:0.8mmol(32mM in H2O),reaction temperature:65℃.Phenol:△:PMo11V,●:PMo10V2,○:PMo9V3,▲:PMo8V4,□:PMo12.Hydroquinone:◆:PMo8V4,◇:PMo10V2.Hydrogen peroxide was added in a single step. この反応条件下では過酸化水素を反応系に加えた直後に多量の酸素が生成した。そこで,Fig.2aと同じ条件で別に実験を行い,ベンゼン酸化反応中の酸素の発生量を測定した。得られた過酸化水素分解の経時変化をFig.2bに示す。同時間におけるFig.2aから求めた過酸化水素のフェノールへの利用率(過酸化水素基準のフェノール収率)と分解率の和は77-92%となり,大部分の過酸化水素が反応初期にフェノールの生成と酸素への分解に使用されていることがわかった。Fig.2の反応条件下ではPMo9V3やPMo10V2のフェノール収率が高かったが,これらの値は36-37%程度であった。これは,先に述べたように過酸化水素自身の分解が反応と同時に進行しているためである。そこで,酸化剤である過酸化水素の利用率を向上させるため,添加する過酸化水素の量,水溶液の濃度(○,▲)および添加時間(●)の効果を検討した。結果をFig.3に示す。過酸化水素添加総量が1.08 mmolの場合の○,▲,●に注目する。10.8Mの過酸化水素を注射器で一度に添加すると(○),フェノール収率は29%であった。一方,添加する過酸化水素濃度を1/10にして(1.08M)一度に加えると(▲),フェノール収率は36%に増加した。さらに,10倍に希釈(0.108M)したものを滴下漏斗で45分かけてゆっくり滴下すると(●),フェノール収率は91%まで増大した。 Fig.3で低濃度の過酸化水素をゆっくりと滴下することによりフェノール収率が増加することがわかったので,滴下速度がフェノール収率に及ぼす効果を検討した。結果をFig.4に示す。添加時間とともにフェノール収率は増加し,45分で91%となった。  Fig.3. Effect of concentration and amount of hydrogen peroxide on the yield of phenol. Fig.3. Effect of concentration and amount of hydrogen peroxide on the yield of phenol.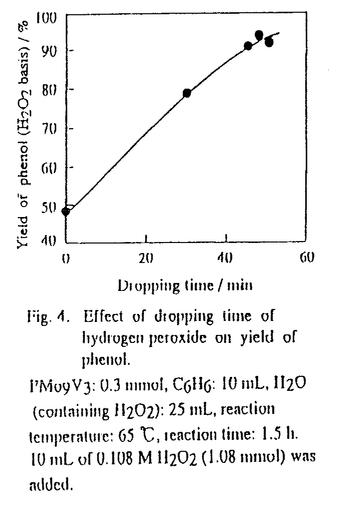 Fig.4. Effect of dropping time of hydrogen peroxide on yield of phenol. Fig.4. Effect of dropping time of hydrogen peroxide on yield of phenol. 次に過酸化水素を希釈し,かつ45分かけてゆっくり滴下する方法を用い,反応の最適温度を検討した。PMo10V2は65℃で最大フェノール収率93%を示した。過酸化水素基準のフェノール収率91-93%の値はこれまで報告された他の触媒と比較してもかなり高い値である。 (2)反応機構 以下では反応機構を検討するためにフェノール収率の高いPMo9V3の触媒量を減らし,かつ過酸化水素を一度に加えた。その結果,過酸化水素分解の誘導期(後述)が観測りできた。 まず,反応場を検討した。反応系はベンゼンと水の二相系である。水量,過酸化水素量を一定にし,ベンゼン量,撹拌速度を変えさせても,フェノール収率はベンゼン量と撹拌速度にはほとんど依存しなかった。したがって,反応は主に水相で起こっていると推測される。実際,ヘテロポリ酸はほとんど水相に溶けている。過酸化水素も主として水相に溶解していることも本反応が主に水相で進行することを支持している。 次に,ベンゼン酸化と過酸化水素分解反応を比較するため,反応温度を32℃に下げた(Fig.5)。この時,フェノール生成と過酸化水素分解との関係がより明確になった。すなわち,過酸水素分解の遅い誘導期ではフェノールの生成は遅く,過酸化水素分解が速く進行している段階でフェノールも急激に増加した。したがって,フェノールは過酸水素分解と同じ化学種から生成していると考えられる。このようなフェノール生成活性と過酸化水素分解反応活性との対応関係はFig.2a,bにおけるPMo12-nVn触媒のそれぞれの反応に対応する活性序列にも見られる。過酸化水素の分解速度は触媒間で異なり,PMo12<PMo11V<PMo10V2<PMo9V3<PMo8V4の順になった。これはフェノールの初期生成速度の序列 とおおむね一致している。したがって,フェノールの生成は過酸化水素の分解とともに進行すること,PMo12の置換したバナジウムの数が多いほど過酸化水素の分解および併発するベンゼンの酸化反応に対する触媒活性が高くなることがわかった。 とおおむね一致している。したがって,フェノールの生成は過酸化水素の分解とともに進行すること,PMo12の置換したバナジウムの数が多いほど過酸化水素の分解および併発するベンゼンの酸化反応に対する触媒活性が高くなることがわかった。  Fig.5.Oxidation of benzene with hydrogen peroxide at 32℃. Fig.5.Oxidation of benzene with hydrogen peroxide at 32℃. 以上よりベンゼンの過酸化水素による酸化反応機構をScheme1のように推定した。過酸化水素添加時にヘテロポリ酸はいったん一部分が分解する。実際,H3PM12O40(M=W,Mo)では過酸化水素とヘテロポリ酸の反応によりポリ酸の分解が進行することが報告されている。Fig.5において誘導期が見られることから,ここで生成する化学種はベンゼン酸化反応と過酸化水素分解反応に不活性であると推定される。過酸化水素の濃度が高いほど誘導期が長くなるのは,反応不活性種が,過酸化水素濃度が高い場合に生成しやすいかあるいは安定であるためであろう。そして,その後ゆっくりと反応活性種が生成すると考えられる。また,誘導期間中にゆっくり生成した反応活性種は速やかに二つの経路で反応するものと推定される。一つは,酸素と水を生成するもの(ステップ(1))であり,他は,ベンゼンを酸化しフェノールを生成するもの(ステップ(2))である。 Scheme1の(1),(2)二つの競争反応の中で,(1)は活性酸素種間の反応であり,過酸化水素に対して(2)より高い濃度依存性を示す。したがって,本論文で過酸化水素を希釈し,かつ滴下する方法が高いフェノール収率(過酸化水素基準)を与えたのは,活性酸素種濃度を低く抑えられるため酸素の発生が抑制されたためと推定される。  Scheme1.Reaction pathway3.2.2フェノールの選択的酸化反応7) Scheme1.Reaction pathway3.2.2フェノールの選択的酸化反応7) 本研究の一環としてバナジウム置換したヘテロポリ酸(PMo10V2)にFe2+を添加した二元触媒を用いてフェノールの酸化反応を行った。水/クロロホルムの二相反応系でPMo10V2を触媒とした場合は,p-ベンゾキノンの他にマレイン酸,シュウ酸,タール状の生成物が観測された。一方,PMo10V2にFe2+を添加する二元触媒を用いて反応を行うとp-ベンゾキノンが収率46%,選択率94%で得られることがわかった。これは新規な反応である。すなわち,金属イオンの添加によりフェノールの酸化も選択的に進行することがわかった。 [発表状況] 1)Science in China(seriesB),33,1032(1990).2)Chem.J.Chinese Univ.5,109(1989). 3)J.Inorg.Chem.,19,65(1993).4)Chinese Chemical Letters,4,319(1993). 5)Stud.Surf.Sci.Catal,,110,35(1997).6)日本化学会誌,1,23(1998).7)日本化学会誌,投稿中. |
| 審査要旨 | | 本論文は「バナドモリブドリン酸触媒による過酸化水素を用いた芳香族の選択的酸化反応」と題し,種々のヘテロポリ酸の酸化力を実験的に比較した上で,酸化力の高いバナジウムを置換した12-モリブドリン酸を触媒として過酸化水素によるベンゼンおよびフェノールの酸化反応を行い,反応条件を最適化を行うとともに本触媒系の特徴を検討したもので,5章からなる。 第1章は序論で,ケギン,ドーソン型ヘテロポリ化合物の構造,酸化力および酸化触媒とする特徴を解説し,特にバナジウムを含む混合配位ヘテロポリ酸の酸化触媒の作用および代表的な反応例を中心に議論するとともに本研究の目的,意義を述べている。 第2章は各種ヘテロポリ酸の酸化力を実験的に測定した結果を述べている。ヘテロポリ酸の酸化力制御および酸化触媒の設計のため,ポーラログラフィ,サイクリックボルタンメトリーを用いて種々のモリブデン,タングステン系ヘテロポリ化合物の酸化還元電位を測定し,中心原子,配位原子,対カチオンのヘテロポリ酸の酸化力に及ぼす影響を検討した。その結果,ケギン型ヘテロポリ酸について同じ配位原子の場合,酸化力(第一半波電位)は中心原子の電気陰性度の増大とともに単調に増大すること,中心原子が同じ場合,配位原子をバナジウムに置換すると酸化力は顕著に増大すること,ヘテロポリアニオンの負電荷が大きいほど酸化力は減少すること,また,ヘテロポリアニオンの負電荷が同じ場合アニオンの半径が小さいほど酸化力は小さくなることを明らかにしている。さらに,構成元素が同じ場合,ドーソン型ヘテロポリ酸はケギン型より酸化力が高いことを示した。 第3章では,高い酸化力をもつことがわかったバナジウム置換したヘテロポリ酸を触媒としてベンゼンの一段酸化によりフェノールの合成を行った結果について述べでいる。H3+nPMo12-nVnO40(n=2,3)で91-93%のフェノール収率(過酸化水素基準)を見出しているが,この値は他の触媒系と比較してもかなり高い値である。ついで,反応条件の影響を検討したのち,速度論的考察から,過酸化水素の酸素と水への分解反応がフェノールの生成反応と同時に進行すること,過酸化水素の酸素への分解がベンゼン酸化への有効利用率低下の原因となることが明らかにした。さらに,これらの知見をもとに過酸化水素有効利用率の過酸化水素濃度依存性,過酸化水素の添加量および添加時間依存性を検討し,添加する過酸化水素を希釈しかつゆっくり滴下する方法がフェノール収率および選択率の向上に有効であることを見出した。また,反応機構の検討から,本反応が主に水相で起こってること,反応活性種はヘテロポリ酸が過酸化水素との反応により一部分解してから生成することを推定した。 第4章では,バナジウムを含むヘテロポリ酸に金属イオンを添加した複合触媒を用い,低濃度の過酸化水素を酸化剤とするフェノールからp-ベンゾキノンへの酸化反応を行った結果について述べている。すなわち,水/クロロホルム/酢酸の二相系で,2-バナド-10-モリブドリン酸にFe2+イオンを添加した系で,フェノール転化率49%,p-ベンゾキノン選択率94%(収率46%)が得られることを見出した。このようにフェノールを酸化しベンゾキノンを選択的に生成する最初の触媒例である。 第5章は総括である。 以上,本論文は,種々のヘテロポリ酸の酸化力の比較を行い,その知見をもとにバナジウムを含むヘテロポリ酸の高い酸化力を生かして芳香族系化合物の酸化反応を行い,高選択的反応系を開拓したもので,触媒化学,有機反応化学に貢献するところ大である。よって,本論文は博士(工学)の学位申請論文として合格と認められる。 |