| 緒論 S原子は比較的反応性の高い化学種であるが、周期表で同じ6族に属するO原子に比べて、その反応性に関する研究は少ない。一般に周期表の第2周期の元素と第3周期以降の元素では、大きく反応性が異なることが知られている。原子の違いによる反応性の違いを考える上で、性質に類似点と相違点をもつ、同族元素の反応性を比較することは有意義である。 H2Sなどの含硫化合物やS原子の反応は、化石燃料の燃焼や、その排出物であるSOxがもたらす環境問題において重要な反応である。石炭や石油中の有機硫黄は燃焼の初期過程で熱分解を受け、主にH2Sや低級チオールの形で燃焼ガス中に放出されると考えられている。H2Sや低級チオールから熱分解や酸化反応によって生成する、S原子やラジカルのHSは、燃焼ガス中の炭化水素や酸素分子などと反応して、燃焼・酸化が進行すると考えられるが、その反応性や反応機構についてはよく知られておらず、素反応の速度定数測定を含んだ燃焼・酸化過程の検討が必要である。 本研究の目的は、S原子と他の重要な分子との反応についての情報を実験的に獲得することと、その反応性をO原子の反応性と比較し、その相違性や類似性が、元素のどのような性質から生じているかを検討することである。 この目的のために本研究ではS原子とH2,H2S,C2H4,O2のそれぞれの分子との反応の速度定数の温度依存性や圧力依存性を主として1000〜1600Kの高温領域で測定した。H2,H2S,O2との反応については反応による生成物を直接観測し、反応の分岐率を決定した。さらにO2との反応では室温における反応の測定を行い、広い温度領域にわたる温度依存性の検討を行っている。得られた結果は過去に報告された実験値やO原子の反応と比較され、その相違性の原因について考察された。 実験装置 衝撃波管:高温領域での実験には無隔膜型の衝撃波管を用いた。管径4.8cm、低圧部長4mの衝撃波管の管端からArFレーザ(193nm)もしくはKrFレーザ(248nm)を照射し、OCSの光分解により生成するS原子(182.6nm)及び反応生成物であるH原子(121.6nm)とO原子(130.5nm)の濃度時間変化を原子共鳴吸光法(ARAS)で測定した。 S原子共鳴吸光の校正は実験条件によって、3000K前後でのOCSの熱分解反応や、OCSの光分解反応を用いて行った。 VUVLIF:室温の実験には、レーザ光分解-真空紫外レーザ誘起蛍光法(LP-VUVLIF)を用い、S(3Pj)とO(3Pj)の3つのスピン軌道状態の相対濃度の時間変化をそれぞれ別々に測定した。S原子生成にはOCSのArFレーザ(193nm)による光分解を用いた。  図1S+H2反応のArrheniusプロットS+H2反応 図1S+H2反応のArrheniusプロットS+H2反応 S+H2反応はS原子と最も単純な燃料との反応であり、H2Sの熱分解反応後続過程のひとつとして重要な反応である。HS濃度が高いような燃焼ガス中では逆反応のHS+H反応が、S+H2S反応の逆反応であるHS+HS反応とともに、S原子生成に寄与していると考えられる。 得られた反応のArrheniusプロットと速度定数のArrhenius表現を図1に示す。また反応によって生成するH原子の濃度時間変化を測定し、数値計算と比較した結果、反応は主にHSとHを生成する経路で進行する。この経路のエンタルピー変化は実験によって得られた反応の活性化エネルギーとほぼ等しい。遷移状態の形状を直線状にとったAb initio計算で得られた反応のエネルギー曲面では、S+H2反応は末期障壁であり鞍点のエネルギーは生成物のエネルギーに近く、実験結果をよく説明している。これに対してO+H2反応は比較的早期障壁であり、反応熱より40kJ/mol以上高い活性化エネルギーを持つことが知られている。このような違いはHSがOHに比べて結合が弱いことと励起エネルギーが低いことを考慮し、分子軌道の相関を考えることで説明できる。 また、より高圧の条件ではH2Sを生成する再結合反応がS原子減少に寄与する可能性があるが、この再結合反応はH2Sの熱分解反応の逆過程である。 H2Sの熱分解開始過程は従来、HS結合の単純な開裂により進行すると考えられていたが、最近、反応がH2分子とS原子を生成する分子機構によって進行するという報告がある。H2Sの熱分解によってS原子とH2が生成するためには1重項曲面と3重項曲面の間での乗り移りが必要であるが、ab initio計算によって計算された乗り移り点のエネルギーは、この分子機構を支持している。しかしH2S熱分解反応の速度定数の値は、報告しているグループによって大きく食い違っている。 そこでS+H2反応の速度定数をより低い温度領域、広い全密度領域で測定し、再結合反応の寄与を検討して、報告されているH2S熱分解反応速度から平衡定数を用いて計算された再結合反応速度と比較した。  図2S+H2S反応のArrheniusプロットS+H2S反応 図2S+H2S反応のArrheniusプロットS+H2S反応 S+H2S反応はS原子と最も単純な含硫燃料との反応であり、S+H2反応と同様、H2Sの熱分解反応後続過程のひとつとして重要な反応である。 得られた反応のArrheniusプロットと速度定数のArrhenius表現を図2に示す。反応によって生成する可能性のあるH原子は観測できなかったが、H原子は生成たとしてもH2Sと速く反応し消失するので、H原子生成経路がないと断言できない。数値シミュレーションとの比較により、H原子生成経路の分岐率は0.2以下と結論され、主な反応生成物はHS+HSだと考えられる。 S+H2S反応でも反応の活性化エネルギーは反応のエンタルピー変化とほぼ等しくなっている。S原子と低級飽和炭化水素との反応でも同様の結果が報告されているが、これらの反応障壁の構造はS+H2反応の場合と同様に説明できる。 S+C2H4反応 S+C2H4反応はS原子と最も単純な不飽和炭化水素との反応として重要な反応である。室温領域では生成物が再結合反応によるThiiraneのみであることが知られている。それに対しO+C2H4反応は室温でも挿入反応後の解裂を起こし、H原子やCH3を生成する経路が主要であると報告されており、高温領域では引き抜き反応のエンタルピー変化に対応した活性化エネルギーを示すとの報告がある。 得られた反応のArrheniusプロットと速度定数のArrhenius表現を過去の報告等と共に図3に示す。本研究では引き抜き反応に相当するような活性化エネルギーは観測されず、1400Kまでの温度領域で、反応が再結合反応として進行すると考えられる。この原子による反応性の違いはS原子を含む化合物のエネルギーが対応するO原子の化合物のエネルギーよりも大きく、その結果反応障壁が大きくなって反応経路が制限されているためだと考えられる。 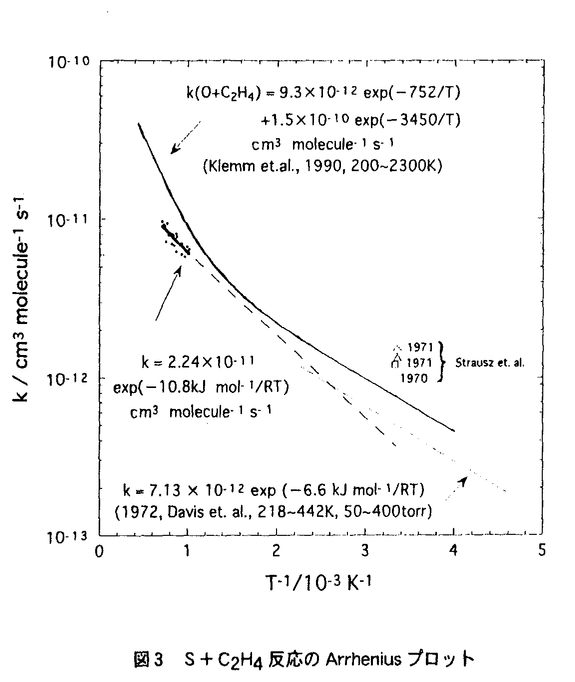 図3S+C2H4反応のArrheniusプロットS+O2反応 図3S+C2H4反応のArrheniusプロットS+O2反応 S(3P)とO2の反応は、S原子の基本的な酸化反応である。この反応の速度定数は、420K以下ではほぼ温度依存がみられないことが知られている。しかし最近の報告によれば、1200K以上の温度領域で速度定数は急激に上昇する。このような強い非Arrhenius温度依存は、単一の反応径路を考えたTST理論では説明できない。 高温領域ではすでに反応経路が主にSOとOを生成する経路だと報告されている。 図4に室温の反応における、S原子とO原子の濃度時間変化を示す。室温で速度定数に圧力依存はなく、生成物は高温領域と同じ、SOとOである。 室温で再結合反応の寄与がないにもかかわらず強い非Arrhenius温度依存がみられる要因として、反応障壁を持つ多重項ポテンシャル面の寄与が考えられる。これは反応物S+O2が27重に縮退しているのに対し最もエネルギーの低い1A’の経路は縮退していないためである。 S(3Pj)の3項間の緩和速度を室温で測定した結果、ArとN2による緩和は項間のエネルギー差が大きくなるほど緩和速度が小さくなるのに対して、O2による緩和では緩和速度は緩和の終状態に依存しており、k01:k02:k12=1:5:5である。これはS(3Pj)の3重項のすべてと相関している付加体での緩和を考えることにより説明できる。S-O-Oの励起状態については知られていないが、オゾンとの類推から、反応物にエネルギーの近い3重項の3A"や3A’があると考えられる。本研究の結果から、室温では反応に寄与しないこれらの多重項曲面が、高温領域では反応経路として寄与していると考えられる。  図4 S+O2反応におけるS原子とO原子の濃度時間変化まとめ 図4 S+O2反応におけるS原子とO原子の濃度時間変化まとめ 4つの反応についてそれぞれ反応速度と反応機構について考察した。引き抜き反応や、挿入反応後の解離などのようにエネルギー障壁を持つような反応ではS原子とO原子の反応性の違いは顕著であるが、再結合反応や引き抜き反応でもエネルギー障壁の少ないような反応では似かよった反応性を示す。 |