学位論文要旨
| No | 113504 | |
| 著者(漢字) | 永田,晋治 | |
| 著者(英字) | ||
| 著者(カナ) | ナガタ,シンジ | |
| 標題(和) | カイコ前胸腺刺激ホルモンの糖鎖構造と受容体に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 113504 | |
| 報告番号 | 甲13504 | |
| 学位授与日 | 1998.03.30 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(農学) | |
| 学位記番号 | 博農第1863号 | |
| 研究科 | 農学生命科学研究科 | |
| 専攻 | 応用生命化学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 昆虫の脳で合成される前胸腺刺激ホルモン(prothoracicotropic hormone:PTTH)は、前胸腺に作用し、エクジソンの合成分泌を促進するペプチドホルモンであり、エクジソンの合成分泌を調節することによって昆虫の脱皮、変態の時期を決定するという重要な役割を果たしている。これまでの研究からカイコ(Bombyx mori)PTTHは224残基の前駆体として翻訳された後、プロセシングを受け、前駆体のうちC末端にコードされている109残基のペプチドが2本ジスルフィド結合で架橋したホモダイマー構造をとることが明らかになっている。さらに大腸菌で発現させたPTTHを用いてペプチド鎖間の1対のジスルフィド結合およびペプチド鎖内の3対のジスルフィド結合の架橋様式も決定されている。また、天然物の解析から41残基目のAsnには糖鎖が付加しているものと考えられている。一方、PTTHの作用機序に関しては活性発現のためには細胞内へのCa2+の流入が必要であること、cAMPの上昇をともなうことなど断片的な情報が得られているにすぎない。 本研究ではカイコPTTHの構造のうち残されている糖鎖構造を明らかにするとともに、PTTHの作用機序を分子レベルで解析するための第一歩としてPTTH受容体の解析を試みた。 天然物を用いたペプチド側およびcDNAの解析から41残基目のAsnにはN-結合型糖鎖の付加が予想されていた。第一部ではこの糖鎖構造を決定することを試みた。天然のPTTHは微量しか得られないことから、まず天然物と類似の糖鎖構造の付加が期待されるバキュロウィルス発現システムで得られたPTTHを用いて糖鎖構造解析法を確立し、その糖鎖構造を決定した。続いて、その解析法を用いることによってカイコ蛾頭部180万頭から精製した天然のPTTHの糖鎖構造を決定した。 成熟カイコPTTHのすぐ上流にシグナルペプチドを付加したバキュロウィルス発現用ベクターを構築し、野生型のバキュロウィルスとの相同組換えにより組換え体ウィルスを作製した。この組換え体ウィルスをカイコ幼虫に感染させ、感染後3日目のカイコ幼虫8頭から3mlの体液を採取し、6段階の精製法により、1.4mgのバキュロウィルス発現カイコPTTH(以下B-rPTTHと呼ぶ)を得た。単離したB-rPTTHは天然PTTHおよび大腸菌発現PTTH(以下E-rPTTHと呼ぶ)と同じくGlyから始まるN末端配列を与えたが、ウェスタンブロッティングでは還元条件下でE-rPTTHよりもわずかに大きな分子量を示し、TOF-MSを用いた質量分析においてもB-rPTTHの分子量はE-rPTTHよりも約900大きかった。 B-rPTTHおよびE-rPTTHをリジルエンドペプチダーゼで消化し、逆相HPLCを用いてペプチドマッピングを行った。その結果、41残基目のAsnを含むペプチドフラグメントのみ溶出位置が異なり、さらにB-rPTTH由来のフラグメントがE-rPTTH由来のものより分子量が約900大きいことが質量分析により確かめられた。また、B-rPTTH由来のフラグメントをPNGase Fで消化した場合も分子量が約900低下したことから、このフラグメントは分子量約900のN-結合型糖鎖を有していると考えられた。次にこの糖ペプチドを数種類のエキソおよびエンドグリコシダーゼで消化し、消化による分子量の変化と各グリコシダーゼの基質特異性から、付加している糖鎖を次のような構造であると推定した。 Man さらに未決定であった2カ所の結合様式を決定するために、糖ペプチドから糖鎖を切り出し、ピリジルアミノ化後、HPLCによる二次元糖鎖マップ法を用いて結合様式を決定した。その結果、B-rPTTHに付加している主要な糖鎖は図1に示す構造であった。 天然PTTHの糖鎖構造を決定するため、既に確立されていた精製法を一部改良し、180万頭のカイコ蛾頭部から合計117  これまでカイコおよびカイコと同じ鱗翅目に属するタバコスズメガを用いた研究から、PTTHが前胸腺に作用し、エクジソン分泌を促進する際には、細胞内へのCa2+の流入、細胞内のcAMPの上昇、細胞内の特定のタンパク質のリン酸化などが起こることが知られている。また、PTTHによるエクジソン分泌促進は限られた成長時期の前胸腺のみで起こることから、受容体レベルでの調節機構の存在も考えられる。したがって、PTTH受容体を同定することは、今後PTTHの作用機序、前胸腺におけるエクジソンの合成分泌促進の分子機構を解明する上で極めて重要である。本研究では前胸腺に存在するPTTH受容体の性質を明らかにするとともに、その構造を明らかにするため発現クローニング法による受容体遺伝子のクローニングを試みた。 PTTH感受性の時期である吐糸直前の5齢幼虫から摘出した前胸腺を材料に、125Iで標識したPTTHを用いて結合実験を行った。その結果をスキャッチャード解析したところ、1本の直線関係が得られたことから前胸腺に存在するPTTH受容体は1種類であり、解離定数は54pMと極めて親和性が高いことが明らかとなった。また、前胸腺の一細胞あたり約16,000個の受容体分子が存在していると考えられた。一方、架橋実験から受容体の分子量は約70,000であり、ジスルフィド結合によるサブユニット構造はとっていないと考えられた。 第一章の結果から、前胸腺を材料にPTTH受容体の構造をタンパクレベルで明らかにすることは不可能であると考え、遺伝子側からの解析を行うためにcDNAライブラリーを構築した。その際、COS7細胞を用いた発現クローニングを行えるように、ベクターとして動物細胞発現用でSR 構築したcDNAライブラリーを150クローンずつサブプールに分け、COS7細胞に形質転換し、COS7細胞と125I-PTTHとの結合を指標にスクリーニングを行った。合計約2千プール(30万クローン)のスクリーニングを行った結果、1つのサブプールに125I-PTTHとの結合活性が認められた。しかし、このサブプールを40クローンずつに分け、100プールをスクリーニングしたが、陽性プールを得ることが出来なかった。 構築したcDNAライブラリー全体をCOS7細胞に導入し、3日間培養後、ビオチン化PTTHを添加し、洗浄後抗ビオチン抗体をコーティングしたプレート上に付着させた。付着した細胞からプラスミドを回収、大腸菌に形質転換し、増幅させた後、再びCOS7細胞に導入し、PTTH受容体cDNAの濃縮を試みた。その結果、5回のパニングによる濃縮でプレート上に付着する細胞数は順次増加し、回収したプラスミドの泳動パターンから特定サイズのプラスミドが濃縮されていることがわかった。しかし、さらに2回のパニングを行ってもその電気泳動パターンは変化せず、複数のバンドが認められたため、濃縮されたサブライブラリーからランダムに12クローンを選び、塩基配列を解析した。その結果、3クローンが長さが異なる同一のcDNAをコードしているプラスミドであることが明らかとなった。そこで一番長い1.8kbpのインサートを有するプラスミドの全塩基配列を解析したが、受容体の特徴をもつタンパク質はコードされていなかった。以上の2つのスクリーニング法によるPTTH受容体のクローニングを試みたが、最終的に受容体cDNAを得ることはできなかった。今後PTTH受容体遺伝子のクローニングのためには、COS7細胞発現系を用いた別のスクリーニング法を試みるとともに、Xenopus oocytes発現クローニング法など全く別の方法を試みる必要があると思われる。 | |
| 審査要旨 | 昆虫の脱皮変態を制御する前胸腺刺激ホルモン(prothoracicotropic hormone,PTTH)の化学構造研究は約30年にわたって主に日本人研究者によって進められてきた。その結果、PTTHは109アミノ酸残基からなる糖タンパク質のホモダイマーであることがわかった。本論文は、未決定であった糖鎖の構造を決定するとともに、PTTHの作用機序を分子レベルで解析するための第一歩として、その受容体の解析を試みたものであり、二部からなる。 第一部では、PTTHの構造で唯一未決定であった41残基目のAsnに結合した糖鎖の構造を、最近発展してきた糖鎖構造決定技法と時間飛行型質量分析とを組み合わせて、決定した。すなわち、まずカイコバキュロウィルス発現系を用いて1.4mgの糖鎖を付加したPTTHを合成し、活性を有するPTTHを単離した。これをリジルエンドペプチダーゼで消化し、糖鎖を含むペプチド断片を分離した。その断片をいくつかのグリコシド結合特異的なグリコシダーゼで消化し、それぞれの消化物について質量分析および還元末端をピリジルアミノ化した蛍光誘導体に導いた後、2種類のカラムを用いた高速液体クロマトグラフィーの溶出位置を既知の糖と比較することにより、Asnに結合した5残基の単糖(マンノース2残基、N-アセチルグルコサミン2残基、フコース1残基)から成る糖鎖構造をMan 第二部では、PTTHの作用の分子機構を明らかにすることを目的にして、前胸腺細胞の膜表面に存在していると考えられるPTTH受容体の性状を明らかにした。すなわち、PTTHを放射性ヨードでラベルし、前胸腺細胞と結合させ、化学的に架橋した後、膜画分を可溶化し、電気泳動で分析することによってPTTH受容体の分子量が約7万であることを示した。また、結合実験の結果をスキャッチャード解析することによって、解離定数が54pM、前胸腺細胞1個当たり約1万6千分子の受容体が存在することを明らかにした。この受容体の数から考えると、受容体の化学構造の解析をタンパク側から行うことは極めて困難であると判断されたので、受容体遺伝子をクローニングすることを試みた。まず、多くの前胸腺を得ることが困難なため、少ない前胸腺を材料にして質のよいライブラリーを作製する方法を開発した。このライブラリーをCOS7細胞に形質導入し、パニング法、放射性ラベルしたPTTHとの結合および蛍光ラベルしたPTTHとの結合を基本にした3種類のスクリーニング方法を用いて目的のクローンを濃縮することを試みたが、いずれの方法でも目的のPTTH受容体をコードしていると考えられるクローンを得ることはできなかった。 以上、本論文は糖タンパク質ホルモンであるPTTHの糖鎖の構造を決定することによって、PTTHの最終構造を提出し、さらにPTTHの受容体に関する基本的性状を明らかにしたものであり、学術上寄与するところが大きい。よって、審査委員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54641 |
 Man
Man  1-4GlcNAc
1-4GlcNAc )GlcNAc-Asn(□部分は上記の実験からは推定できなかった結合様式)。
)GlcNAc-Asn(□部分は上記の実験からは推定できなかった結合様式)。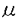 gのPTTHを精製した。精製したPTTHのリジルエンドペプチダーゼ消化物をHPLCにより分析したところ、B-rPTTHの場合と同じ溶出位置に糖ペプチドと思われるフラグメントが溶出された。次に得られた糖ペプチドを各種グリコシダーゼで消化した後、TOF-MS測定を行ない、その分子量の変化から糖鎖構造を推定した。その結果、天然のPTTHの糖鎖構造はB-rPTTHと同一の構造であることが示唆された。そこで、B-rPTTHと同様に糖ペプチドから糖鎖を切り出し、ピリジルアミノ化後、ODSカラムを用いたHPLCにより分析したところ、その溶出時間が完全に一致した。したがって、天然PTTHに付加している糖鎖の構造はB-rPTTHのものと同一であると判断した。(図1)
gのPTTHを精製した。精製したPTTHのリジルエンドペプチダーゼ消化物をHPLCにより分析したところ、B-rPTTHの場合と同じ溶出位置に糖ペプチドと思われるフラグメントが溶出された。次に得られた糖ペプチドを各種グリコシダーゼで消化した後、TOF-MS測定を行ない、その分子量の変化から糖鎖構造を推定した。その結果、天然のPTTHの糖鎖構造はB-rPTTHと同一の構造であることが示唆された。そこで、B-rPTTHと同様に糖ペプチドから糖鎖を切り出し、ピリジルアミノ化後、ODSカラムを用いたHPLCにより分析したところ、その溶出時間が完全に一致した。したがって、天然PTTHに付加している糖鎖の構造はB-rPTTHのものと同一であると判断した。(図1) プロモーターを有するpME18Sを用いた。前胸腺は1対あたりわずか約1,000個の細胞から構成されているため少量の材料から効率良く、しかも質の良いライブラリーを構築するため、mRNAの精製法、反応条件などを様々に変えてcDNAライブラリーの構築を試みた。その結果、最終的にわずか100匹のカイコの前胸腺から7.2x106の組み換え体を含むライブラリーを作製することに成功した。このライブラリーは1kbp以上のインサートが90%以上の割合で含まれており、PTTH受容体をスクリーニングするのに十分であると考えられた。
プロモーターを有するpME18Sを用いた。前胸腺は1対あたりわずか約1,000個の細胞から構成されているため少量の材料から効率良く、しかも質の良いライブラリーを構築するため、mRNAの精製法、反応条件などを様々に変えてcDNAライブラリーの構築を試みた。その結果、最終的にわずか100匹のカイコの前胸腺から7.2x106の組み換え体を含むライブラリーを作製することに成功した。このライブラリーは1kbp以上のインサートが90%以上の割合で含まれており、PTTH受容体をスクリーニングするのに十分であると考えられた。