ウレアーゼは、尿素をアンモニアと二酸化炭素に加水分解し、活性中心にニッケルを含む金属酵素である。微生物、植物に広く分布しており、泌尿器や胃腸に感染する細菌に、ウレアーゼ活性を有する病原菌が多数存在するため病理学的な面から近年注目を浴びている。一方、土壌より分離した好熱性バチルスTB-90株のウレアーゼは、耐熱性、pH安定性に優れており、また尿素に対するKm値も他の微生物由来のものに比べかなり小さいことから、臨床検査等に応用していく上で非常に有用な酵素である。TB-90株ウレアーゼは、3種のサブユニット(UreA,UreB,UreC)で構成されており、その分子量より(UreA UreB UreC)3なる三量体を形成し、またそのアミノ酸配列の特徴よりニッケルを結合する活性中心はUreCにあるものと考えられる。 TB-90株ウレアーゼ遺伝子群は本研究室においてクローン化されたが、構造遺伝子(ureA,ureB,ureC)と6つのアクセサリー遺伝子(ureE,ureF,ureG,ureD,ureH,ureI)がクラスターをなし、これら9つのORFは単一のオペロンを形成すると考えられる。アクセサリー遺伝子とは、これらを欠失させると活性のないウレアーゼ蛋白質しか生産されなくなるものとして同定された遺伝子である。このような遺伝子構成は他の細菌のウレアーゼ遺伝子においても一般的に認められるものであることが、最近の研究により明らかになってきている。TB-90株のアクセサリー遺伝子の中でureH、ureIはTB-90株特有のものであり、本研究室における解析から菌体内へのニッケルトランスポーターの働きを担うことが示唆されていた。一方、UreE、UreF、UreG、UreDは、その一次構造がKlebsiella aerogenesの同一名称のタンパク質と相同性を示すことより、K.aerogenesの解析結果をもとに、構造蛋白質翻訳後にこれらのアクセサリー蛋白質が作用することで活性中心形成を補助するものと推測していたが、その詳細については明らかになっていなかった。このような分子シャペロン以外の蛋白質の構造形成に関わる分子の機能を知ることは構造生物学上の重要な課題であることから、本研究では各アクセサリー蛋白質の機能およびウレアーゼ構造蛋白質の翻訳後活性化機構の解明を目標に研究を進めた。  図表1.TB-90株ウレアーゼの大腸菌における発現 図表1.TB-90株ウレアーゼの大腸菌における発現 TB-90株ウレアーゼ遺伝子クラスターをコードする約6.5kbのDNA断片を持つプラスミドpUM011を導入した大腸菌内におけるウレアーゼ発現時期及び培地条件の検討を行った。LB培地ではニッケルを添加しても活性はほとんど観察されなかったが、ammonium-free M9に最終濃度10%LB、10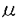 M NiCl2を添加した窒素源の少ない培地で培養した場合、約16時間後に高い活性が得られた。Q-Sepharose及びTOYOPEARL HW-55によって約460U/mgの比活性にまで精製した本酵素は、至適pH、pH安定性、温度安定性すべてにおいて、TB-90株の産生したウレアーゼと同等の特性を示した。以上のことから、TB-90株ウレアーゼの完全な発現にはこの6.5kbの断片で必要十分であると結論した。 M NiCl2を添加した窒素源の少ない培地で培養した場合、約16時間後に高い活性が得られた。Q-Sepharose及びTOYOPEARL HW-55によって約460U/mgの比活性にまで精製した本酵素は、至適pH、pH安定性、温度安定性すべてにおいて、TB-90株の産生したウレアーゼと同等の特性を示した。以上のことから、TB-90株ウレアーゼの完全な発現にはこの6.5kbの断片で必要十分であると結論した。 一方、上記の大腸菌でも、ニッケルを含まない培地で培養すればウレアーゼ活性を持たないが、late-log phaseの培養液に200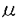 Mのニッケルを加え振とう培養を続けると徐々にウレアーゼ活性が現れ、ニッケル添加4時間後に約10%のウレアーゼ活性まで上昇する。ニッケルを加える30分前に蛋白質合成阻害剤を加えてもこのウレアーゼ活性の発現には影響はなかったが、脱共役剤、ATP合成阻害剤で処理するとウレアーゼ活性の上昇は認められなかった。これらの結果から、in vivoにおいてニッケルを持たず活性のないウレアーゼは活性中心にニッケルを取り込める状態でとどまっていると考えられ、また成熟活性化の過程はエネルギーを必要とする可能性があることが示唆された。 Mのニッケルを加え振とう培養を続けると徐々にウレアーゼ活性が現れ、ニッケル添加4時間後に約10%のウレアーゼ活性まで上昇する。ニッケルを加える30分前に蛋白質合成阻害剤を加えてもこのウレアーゼ活性の発現には影響はなかったが、脱共役剤、ATP合成阻害剤で処理するとウレアーゼ活性の上昇は認められなかった。これらの結果から、in vivoにおいてニッケルを持たず活性のないウレアーゼは活性中心にニッケルを取り込める状態でとどまっていると考えられ、また成熟活性化の過程はエネルギーを必要とする可能性があることが示唆された。 2.アクセサリー蛋白質欠損による他のアクセサリー蛋白質の発現量への影響 上述したように、pUM011よりureF、ureG、ureDを欠失させると、ウレアーゼ活性は全く発現されなくなり、またureE欠失の場合は活性が約半分に減少する。これらの各アクセサリー遺伝子の欠損が構造蛋白質、あるいは他のアクセサリー蛋白質の発現量に影響を及ぼすかどうかを調べる為に、UreC,UreE、UreF、UreG、UreDをMaltose Binding Proteinとの融合蛋白質として精製し、それぞれの蛋白質に対する抗体を得た。これらの抗体を用いて、各アクセサリー蛋白質の同定と産生量の解析をウェスタンプロットにより行った。UreE及びUreGは大量に産生され、主に可溶性画分に存在していたのに対し、UreDの産生量は少なかった。また、UreFのバンドは確認できず、産生量は非常に少ないものと考えられた。アクセサリー遺伝子のいずれの変異においてもUreC及び他のアクセサリー遺伝子産物の発現量には変化が認められない事から、各アクセサリー蛋白質の消失が他のアクセサリー蛋白質の不安定化を引き起こすようなことはなく、それぞれがウレアーゼの成熟化に関与していることが示された。 3.ウレアーゼの試験管内活性化と活性中心における二酸化炭素の必要性 ニッケルを添加しない培地で培養することによって、ニッケルを持たず活性の無いウレアーゼアポ蛋白質と全てのアクセサリー蛋白質を含む大腸菌粗抽出液(以下wild-type crude extract)を調製した。これに最終濃度1mMのNiCl2を加えて37℃でインキュベートしたところ、徐々にウレアーゼ活性が出現することが観察され、約12時間後に最大値に達した。しかしこの値は培地にニッケルを添加して培養した場合の比活性の約5%でしかなかった。また、各アクセサリー蛋白質が欠損した粗抽出液に最終濃度1mMのNiCl2を加え同様の試験管内活性化を行ったところ、UreE、UreF、UreGそれぞれが欠損した粗抽出液ではウレアーゼ活性の回復が観察された。これに対し、UreD欠損の場合には活性は回復しなかった。従って、アポウレアーゼがニッケルを取り込んで活性化する過程にUreDの存在は必須であり、他のアクセサリー蛋白質が欠損していても、UreDが存在すればウレアーゼアポ蛋白質はニッケルを受け入れられる状態に維持されていることが示唆された。 Klebsiella aerogenesのウレアーゼは立体構造が決定されており、活性中心では4つのヒスチジン残基に加えて、リジン残基にCO2が反応して生成したと考えられるカルバミル化リジンがニッケルに配位することが報告されている。この知見に基づき、高いCO2分圧下での試験管内活性化を行ったところ、3%のCO2存在下において、37℃、4時間のインキュベートで約20%の活性回復が観察された。また最終濃度100mMのNaHCO3を添加することでも約25%のウレアーゼ活性の回復が観察され、TB-90株ウレアーゼの活性中心形成にもCO2が関与することが強く示唆された。特にUreD欠損の場合、ニッケル添加のみでは活性回復が全く観察されなかったのに対し、100mM NaHCO3存在下では約8%の活性が回復したことから、UreDの欠損が高濃度のCO2によって相補されたと考えられた。 4.UreDの機能の解析 Wild-type crude extractより抗UreD抗体で免疫沈降させた蛋白質中にはUreCが含まれることがウェスタンプロットにより明らかになり、UreDはウレアーゼアポ蛋白質と複合体を形成することが示唆された。この複合体形成は、UreE、UreF、UreGを一つずつあるいはすべて欠損させた場合にも観察され、UreDはアポ蛋白質に対して他のアクセサリー蛋白質を介さずに結合しているとみられる。アポウレアーゼのみ、ないしはアポウレアーゼとUreD両方を発現させた大腸菌粗抽出液に、NaHCO3と1mMのNiCl2を添加して試験管内活性化を行ったところ、NaHCO3濃度が低いときはUreDの存在が必須であったのに対し、NaHCO3濃度が十分に高いときはUreDの有無に関わらず同程度の活性回復を示した。以上の結果から、UreDが結合したアポウレアーゼはCO2濃度が低くても活性中心の形成が促進されると考えられ、UreDはアポウレアーゼの構造をCO2とニッケルを取り込みやすい状態に保つ分子シャペロン的な機能を持つことが示唆された。 5.UreEの機能の解析 Wild-type crude extractをNi-NTAカラムにかけて1Mイミダゾールで溶出したところ、UreEが溶出された。すなわちUreEはニッケル結合蛋白質であった。TB-90株のUreEは、K.aerogenes UreEで報告されているヒスチジンクラスターを持たないにもかかわらずニッケル結合能を持つ点で非常に興味深い。 また、wild-type crude extractより抗UreE抗体で免疫沈降させた蛋白質中にはUreCが含まれることがウェスタンプロットにより明らかになり、UreEはウレアーゼアポ蛋白質と複合体を形成することが示唆された。特に、ニッケルを含む培地で培養した大腸菌粗抽出液ではニッケル無添加培地の場合と比べて、UreEと共沈するUreCが多く観察された。さらに、ウレアーゼアポ蛋白質及びUreF、UreG、UreDを発現させた大腸菌粗抽出液に、精製したUreE及びニッケルを加え、4℃、1時間インキュベートした後、抗UreE抗体で免疫沈降を行った。この沈降物には構造蛋白質の一つであるUreCが含まれていたが、ニッケルを添加しない場合にはUreCは沈降しなかった。このことから、UreEはニッケル依存的にウレアーゼアポ蛋白質と複合体を形成することが示唆され、UreEはニッケルをウレアーゼ活性中心まで運ぶ働きをしているのではないかと考えられた。 UreF、UreG、UreDを一つずつ欠損した大腸菌粗抽出液を用いて同様の実験を行ったところ、特にUreG欠損の場合にUreEと共沈するUreCが少なかった。また、アポウレアーゼ、UreE、UreGを発現させた大腸菌粗抽出液に200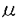 Mのニッケルを加えて4℃、1時間インキュベートした後、抗UreG抗体で免疫沈降させた蛋白質中にはUreC及びUreEが含まれていたことから、UreEとアポウレアーゼとの相互作用にはUreGが関与することが示唆された。 Mのニッケルを加えて4℃、1時間インキュベートした後、抗UreG抗体で免疫沈降させた蛋白質中にはUreC及びUreEが含まれていたことから、UreEとアポウレアーゼとの相互作用にはUreGが関与することが示唆された。 以上、本研究から推測されるウレアーゼ成熟活性化のモデルを下に示す。UreDが結合することによって活性中心を形成しやすい状態に維持されたアポウレアーゼに、CO2そしてUreEによって運ばれてきたニッケルが作用して活性を持つホロ酵素へ成熟化すると考えられる。今後、UreGとUreEとの関係やUreFの機能を探ることによって、ウレアーゼ成熟活性化の全容が解明されることが期待される。  図表 図表 |