| 内容要旨 | | 5配位リン化合物は生体内における情報・エネルギーを伝達する基本的な反応の中間体として非常に重要である.本研究では5配位リン化合物が反応の中核をなすタンパク質・核酸・糖からなる3種類の酵素について量子化学計算による解析を行い,変異酵素の活性予測,活性に重要な部位の特定,反応メカニズムの検証を行うことを目的とする. I.GTP加水分解反応モデルの解析 GTP加水分解反応はGTPaseスーパーファミリーに属するタンパク質の機能において中心的役割を担っている.ras p21,EF-Tu,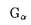 サブユニット等によるGTP加水分解反応ではOH-イオンがリン原子に対して サブユニット等によるGTP加水分解反応ではOH-イオンがリン原子に対して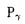 -O結合にin-lineに攻撃した結果, -O結合にin-lineに攻撃した結果, -リン酸のコンフィギュレーションの反転が引き起こされる.触媒に関与する水分子はras p21,EF-Tu, -リン酸のコンフィギュレーションの反転が引き起こされる.触媒に関与する水分子はras p21,EF-Tu,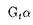  などの結晶構造において,G02原子から3.4-3.8Å離れた位置に観測されている.いずれの結晶構造においても水分子とアミノ酸残基の側鎖との間に強い相互作用は存在しない.水分子よりプロトンを引き抜く塩基として働いているのは基質そのもの,つまり,GTPの などの結晶構造において,G02原子から3.4-3.8Å離れた位置に観測されている.いずれの結晶構造においても水分子とアミノ酸残基の側鎖との間に強い相互作用は存在しない.水分子よりプロトンを引き抜く塩基として働いているのは基質そのもの,つまり,GTPの -リン酸であることが示されている(substrate-assisted catalysis).本研究ではGTP結合タンパク質におけるこのsubstrate-assisted catalysisの反応機構に基づき,半経験的分子軌道法(PM3法)を用いて得たGTP加水分解反応の反応プロファイルからmutationによるGTPase活性の変化を予測した.反応プロファイルの計算に使用したGTP加水分解反応の分子モデルは,1アミノ酸残基,2リン酸,1水分子からなる.アミノ酸残基に隣接する両端の残基は水素で置換し,エネルギー最小化を行った.substrate-assisted catalysisに基づいて,GTP加水分解反応を以下の3つの素反応に分離した:(a)水分子からプロトンが脱離してOH-を生成する反応(反応座標:H-Oの結合長),(b)OH-がリン原子をin-lineに求核攻撃する反応(反応座標:P-Oの結合長),(c) -リン酸であることが示されている(substrate-assisted catalysis).本研究ではGTP結合タンパク質におけるこのsubstrate-assisted catalysisの反応機構に基づき,半経験的分子軌道法(PM3法)を用いて得たGTP加水分解反応の反応プロファイルからmutationによるGTPase活性の変化を予測した.反応プロファイルの計算に使用したGTP加水分解反応の分子モデルは,1アミノ酸残基,2リン酸,1水分子からなる.アミノ酸残基に隣接する両端の残基は水素で置換し,エネルギー最小化を行った.substrate-assisted catalysisに基づいて,GTP加水分解反応を以下の3つの素反応に分離した:(a)水分子からプロトンが脱離してOH-を生成する反応(反応座標:H-Oの結合長),(b)OH-がリン原子をin-lineに求核攻撃する反応(反応座標:P-Oの結合長),(c) リン酸が脱離する反応(反応座標:O-Pの結合長).反応座標の変化に伴う生成熱( リン酸が脱離する反応(反応座標:O-Pの結合長).反応座標の変化に伴う生成熱( Hf)の変化から反応プロファイルを得た.分子モデルのアミノ酸残基の構造はras p21のwild-typeとmutant,そして Hf)の変化から反応プロファイルを得た.分子モデルのアミノ酸残基の構造はras p21のwild-typeとmutant,そして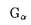 サブユニットの構造をそれぞれ用いた.各残基についてwild-typeとmutantの分子モデルの反応プロファイルから各々の サブユニットの構造をそれぞれ用いた.各残基についてwild-typeとmutantの分子モデルの反応プロファイルから各々の  を求め,その差から を求め,その差から   を得た(図1).実験より得られているmutantとwild-typeのkcatの比(kcat[mutant]/kcat[wild-type])をkrel[experiment]とし,計算された を得た(図1).実験より得られているmutantとwild-typeのkcatの比(kcat[mutant]/kcat[wild-type])をkrel[experiment]とし,計算された   から遷移状態理論により得られるkcat[calculation]=exp(- から遷移状態理論により得られるkcat[calculation]=exp(-   /RT)と比較したところ,定性的には正しい予測結果を得た.本研究により,ras,EF-Tu, /RT)と比較したところ,定性的には正しい予測結果を得た.本研究により,ras,EF-Tu,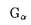 サブユニット等でアミノ酸置換によるGTP加水分解反応の速度を予測することが可能になった.図2で,横軸はkrel[experiment],縦軸はkrel[calculation]を表し,実線に近いほど予測精度が高いといえる.krel[calculation]=1かつkrel[experiment]=1の点の近傍では活性の変化は微小であることを示し,原点では活性がなくなることを示している.○と●は,各々ras p21でwild-typeとmutantの結晶構造がともに既知の場合と,mutantの結晶構造が未知の場合を表している.□は サブユニット等でアミノ酸置換によるGTP加水分解反応の速度を予測することが可能になった.図2で,横軸はkrel[experiment],縦軸はkrel[calculation]を表し,実線に近いほど予測精度が高いといえる.krel[calculation]=1かつkrel[experiment]=1の点の近傍では活性の変化は微小であることを示し,原点では活性がなくなることを示している.○と●は,各々ras p21でwild-typeとmutantの結晶構造がともに既知の場合と,mutantの結晶構造が未知の場合を表している.□は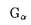 サブユニットの場合では,mutantの結晶構造が未知の場合を表している.G12V,G12P,D38Eについては,結晶解析によりwild-typeとmutantの構造が既知である.G12PとD38Eでの誤差は各々-4.5%,+3.0%であり,定量的に正しく予測されている.G12Vでは予測値が実験値の4.3倍であって精度は低いが,GTPase活性が減少するという点で,定性的には正しいといえる.G12Vのように,計算に含めていない他の残基の構造を側鎖が変化させている場合に,予測精度が下がると考えられる.Q61Eでも,予測値が実験値の4.5倍ではあるが,他の変異と異なり,GTPase活性が101のオーダーで増加するという特徴が一致している.このことは,ras p21のGln61が一般塩基として働いているのではなくsubstrate-assisted catalysisによりGTP加水分解反応が触媒されていることに矛盾しない.K16Hecでも,予測値が実験値の4.2倍ではあるが,GTPase活性が10-3のオーダーで減少する,つまりほとんど活性が消失するという特徴が一致している.これはGTPase活性を持つタンパク質でLys16に相当する残基が1次配列上保存されていることと一致する.ras p21の他の残基や サブユニットの場合では,mutantの結晶構造が未知の場合を表している.G12V,G12P,D38Eについては,結晶解析によりwild-typeとmutantの構造が既知である.G12PとD38Eでの誤差は各々-4.5%,+3.0%であり,定量的に正しく予測されている.G12Vでは予測値が実験値の4.3倍であって精度は低いが,GTPase活性が減少するという点で,定性的には正しいといえる.G12Vのように,計算に含めていない他の残基の構造を側鎖が変化させている場合に,予測精度が下がると考えられる.Q61Eでも,予測値が実験値の4.5倍ではあるが,他の変異と異なり,GTPase活性が101のオーダーで増加するという特徴が一致している.このことは,ras p21のGln61が一般塩基として働いているのではなくsubstrate-assisted catalysisによりGTP加水分解反応が触媒されていることに矛盾しない.K16Hecでも,予測値が実験値の4.2倍ではあるが,GTPase活性が10-3のオーダーで減少する,つまりほとんど活性が消失するという特徴が一致している.これはGTPase活性を持つタンパク質でLys16に相当する残基が1次配列上保存されていることと一致する.ras p21の他の残基や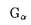 サブユニットの場合も定性的予測に成功している(図2).さらに,この方法をIle36置換体(非天然アミノ酸を含む)に適用した(表1).これらの結果より,Ile36の位置においては-OH基等を持つ極性アミノ酸側鎖に置換する場合にはGTPase活性が上昇し,-COOH基等を持つ負の荷電アミノ酸側鎖に置換するとGTPase活性が低下する傾向が予測された.本研究により,ras,EF-Tuや サブユニットの場合も定性的予測に成功している(図2).さらに,この方法をIle36置換体(非天然アミノ酸を含む)に適用した(表1).これらの結果より,Ile36の位置においては-OH基等を持つ極性アミノ酸側鎖に置換する場合にはGTPase活性が上昇し,-COOH基等を持つ負の荷電アミノ酸側鎖に置換するとGTPase活性が低下する傾向が予測された.本研究により,ras,EF-Tuや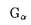 サブユニット等でアミノ酸置換によるGTP加水分解反応の速度を予測することが可能になった. サブユニット等でアミノ酸置換によるGTP加水分解反応の速度を予測することが可能になった.  図1:反応プロファイル(Gln61 & Glu61) 図1:反応プロファイル(Gln61 & Glu61) 図2:krelによるGTPase活性変化の予測値と実験値の比較 図2:krelによるGTPase活性変化の予測値と実験値の比較 表1:Prediction of krel[cal] in Ile36 mutants of ras p21II.リボザイムの反応モデルの解析 表1:Prediction of krel[cal] in Ile36 mutants of ras p21II.リボザイムの反応モデルの解析 1980年代初めに,Cechらによって触媒活性をもつRNA(リボザイム)が発見されて以来,多くの種類のリボザイムが見出されている.これらのなかで,ハンマーヘッド型リボザイムは,最も小さい活性ドメインをもつリボザイムのうちの一つである.ハンマーヘッド型リボザイムの活性は,RNAウィルスに含まれる低分子RNAなどに発見され,マグネシウムイオンの存在下で自己のRNA鎖を切断する.リボザイムのRNA切断機構は,切断箇所のヌクレオシド残基の2’位酸素原子が3’位にあるリン酸ジエステルのリン酸基を攻撃し,隣のヌクレオシド残基の5’残基が脱離し,RNA鎖の切断が起こる.この分子内反応はいわゆるin-line機構で起こる.すなわち,O2’,P,O5’が一直線上に並ぶ遷移状態を経由する.このときの2’-OH基,及びリン酸残基の活性化などにマグネシウム残基が必要とされている.ハンマーヘッドの触媒コアの中において,N7を除くいかなるヌクレオチドに変異を導入しても,その結果として解離活性が10-3以下に低下する.ヌクレオチドを特異的に修飾し,リボザイムの活性が測定された例が多数報告されている.基質の結合の特異性は,ステムIとIIIのおけるワトソン-クリック塩基対によって決定されているため,活性を下げるようなリボザイムコア内での修飾は,基質の結合よりもむしろ,触媒作用に影響するためと考えられている.ただし,活性についての影響は,3次元構造全体の崩れと,または遷移状態の不安定化とのどちらでも発生しうる.本研究では,半経験的分子軌道法を用いてハンマーヘッド型リボザイムの反応解析を行うための分子モデルを提案し,これを用いてリボザイム変異体のRNA切断活性の変化をkrelを予測し,実験値との比較を行い,リボザイム変異による活性の低下の原因が遷移状態の不安定化であるのか,金属イオンの位置変化や3次構造の崩れなどの要因であるのかを検討した.リボザイム分子モデルはall-RNA hammerhead ribozymeの結晶構造(PDB code:1MME)を基に, methyl hydroxyethyl phosphate(MHEP)と修飾したリボース環の部分を半経験的分子軌道法のPM3法を用いて構築した.連続する2つの素反応(リボザイムの閉環とP-O結合切断)について,原子間距離を反応座標として,反応経路計算を行い,反応プロファイルを得た.反応プロファイルの  は平均18kcal/molで,実験より得られている22kcal/molに近い値を得た.野生型リボザイムと変異型リボザイムの反応プロファイルからkrel[calculation](=exp( は平均18kcal/molで,実験より得られている22kcal/molに近い値を得た.野生型リボザイムと変異型リボザイムの反応プロファイルからkrel[calculation](=exp( ))を算出し,実験値であるkrel[experiment](= ))を算出し,実験値であるkrel[experiment](= )との比較を行った.2’水酸基の修飾については,A6のリボースの変異でkrel[calculation]がkrel[experiment]に近い値をとり,最も遷移状態の安定化に寄与していると考えられる. )との比較を行った.2’水酸基の修飾については,A6のリボースの変異でkrel[calculation]がkrel[experiment]に近い値をとり,最も遷移状態の安定化に寄与していると考えられる.  Table.2’-水酸基を修飾したリボザイムにおける触媒活性の変化III.人工リボヌクレアーゼの加水分解反応の解析 Table.2’-水酸基を修飾したリボザイムにおける触媒活性の変化III.人工リボヌクレアーゼの加水分解反応の解析 RNAを加水分解するリボヌクレアーゼの活性部位には2個のimidazole基がある.反応の第一段階として,imidazole基は塩基触媒としてRNAのリボースの2’位の水酸基からプロトンを引き抜き,生成した求核性の2’位の酸素原子がリン酸エステルのリン原子に結合して環状リン酸エステルを生ずる.第二段階として,この環状リン酸エステルが位置選択的に開裂する際に,イミダゾール基は一般酸触媒としてプロトンを酸素原子に供給する.この第二段階目の反応を再現する人工酵素として,2つのimidazole基を持つ -cyclodextrin 6,6’-bis(imidazoles)が合成されている.環状リン酸エステルを分子内にもち, -cyclodextrin 6,6’-bis(imidazoles)が合成されている.環状リン酸エステルを分子内にもち, -cyclodextrin 6,6’-bis(imidazoles)に結合し加水分解される分子として,4-tert-butylcatechol cyclic phosphateが用いられる.本研究では,この2つの分子と水分子との反応系を半経験的分子軌道法を用いて構築し,反応プロファイルを得た.またこの基質分子が -cyclodextrin 6,6’-bis(imidazoles)に結合し加水分解される分子として,4-tert-butylcatechol cyclic phosphateが用いられる.本研究では,この2つの分子と水分子との反応系を半経験的分子軌道法を用いて構築し,反応プロファイルを得た.またこの基質分子が -cyclodextrinに結合する位置を変化させた場合のエンタルピー変化から,エンタルピー的に最も安定な位置を得た. -cyclodextrinに結合する位置を変化させた場合のエンタルピー変化から,エンタルピー的に最も安定な位置を得た. -cyclodextrin 6,6’-bis(imidazoles)には3つの異性体(AB,AC,AD)が存在し,AC体,AD体に比べてAB体が最も大きな活性を示している.AB体では2つのimidazole基が隣接しており,プロトンが結合していないimidazole基(A位)は水分子からプロトンを引き抜き,もう一方のimidazole基(B位)に結合しているプロトンは,環状リン酸エステルの遊離の酸素原子と3’位の酸素原子との両方に水素結合できる位置にある.一方,AC体,AD体では距離的に3’位の酸素原子とのみ水素結合できる位置にある.imidazole基(A位)が水分子からプロトンを引き抜く反応過程で,imidazole基(A位)の炭素原子に結合している水素原子が2’位の酸素原子と水素結合している構造が得られたが,これはimidazole基によりリン酸近傍で水分子がプロトンを引き抜き可能な位置に固定されていると考えられる.以上本研究により, -cyclodextrin 6,6’-bis(imidazoles)には3つの異性体(AB,AC,AD)が存在し,AC体,AD体に比べてAB体が最も大きな活性を示している.AB体では2つのimidazole基が隣接しており,プロトンが結合していないimidazole基(A位)は水分子からプロトンを引き抜き,もう一方のimidazole基(B位)に結合しているプロトンは,環状リン酸エステルの遊離の酸素原子と3’位の酸素原子との両方に水素結合できる位置にある.一方,AC体,AD体では距離的に3’位の酸素原子とのみ水素結合できる位置にある.imidazole基(A位)が水分子からプロトンを引き抜く反応過程で,imidazole基(A位)の炭素原子に結合している水素原子が2’位の酸素原子と水素結合している構造が得られたが,これはimidazole基によりリン酸近傍で水分子がプロトンを引き抜き可能な位置に固定されていると考えられる.以上本研究により, -cyclodextrinを基本構造にもつ人工リボヌクレアーゼの加水分解の素反応の反応プロファイルが得られ,反応に適したimidazole基と基質分子の相対位置が明らかになった.これは -cyclodextrinを基本構造にもつ人工リボヌクレアーゼの加水分解の素反応の反応プロファイルが得られ,反応に適したimidazole基と基質分子の相対位置が明らかになった.これは -cyclodextrinを用いた新たな人工リボヌクレアーゼなどの人工酵素の開発に寄与することが期待される. -cyclodextrinを用いた新たな人工リボヌクレアーゼなどの人工酵素の開発に寄与することが期待される. |
| 審査要旨 | | 本論文では,計算機シミュレーションによって酵素反応を再現し,酵素活性部位の修飾による活性の変化を予測する手法を提案するとともに,生体内における情報・エネルギーを伝達する基本的な反応であるリン酸基の解離・転移反応を触媒する酵素に適用した結果をまとめている。適用した酵素は,GTP加水分解反応を触媒する低分子量GTP結合タンパク質のras p21,RNA加水分解反応を触媒するリボザイム, -シクロデキストリンを基本骨格に持ち,環状リン酸エステル基質の加水分解反応を触媒する人工リボヌクレアーゼの3種類の酵素である。計算により得られた複数の反応プロファイルから反応メカニズムの検証を行い,酵素活性部位の修飾による活性の変化の予測値から,活性に重要な部位の特定,そして実験的に検証されていない新規の修飾を加えた場合の活性変化から,より高い触媒能を持つような酵素の置換方法を提案している。 -シクロデキストリンを基本骨格に持ち,環状リン酸エステル基質の加水分解反応を触媒する人工リボヌクレアーゼの3種類の酵素である。計算により得られた複数の反応プロファイルから反応メカニズムの検証を行い,酵素活性部位の修飾による活性の変化の予測値から,活性に重要な部位の特定,そして実験的に検証されていない新規の修飾を加えた場合の活性変化から,より高い触媒能を持つような酵素の置換方法を提案している。 第一に,低分子量GTP結合タンパク質のGTP加水分解反応について解析している。GTP加水分解反応の遷移状態に対する各アミノ酸残基置換の影響について計算機シミュレーションで初めて解析している。また,実験されていない天然又は非天然アミノ酸残基置換による活性予測から、活性上昇するアミノ酸置換の探索を行っている。従来行われていなかった第3番目の素反応を考慮しているために,律速段階がこちらにシフトしていても活性化エンタルピーが計算できると述べている。活性の上昇,低下の傾向は,計算値が実験値と一致しているので,定性的予測に成功していると述べている。非天然アミノ酸を含むIle36置換体に適用したところ,Ile36の位置においては水酸基等を持つ極性アミノ酸側鎖に置換するとGTPase活性が上昇し,カルボキシル基等を持つ負の荷電アミノ酸側鎖に置換するとGTPase活性が低下する傾向が予測されたと述べている 第二に,ハンマーヘッド型リボザイムのRNA切断反応について解析している。methylhyderoxyethylphosphateと2’水酸基を水素原子又はフッ素原子に置換したリボース環からなる分子モデルを構築し,反応をP-O2’結合生成の素反応とO5’-P結合切断の素反応に分離し、これらの結合距離を反応座標と定義し、反応経路計算より反応プロファイル、そして活性化エンタルピー変化を得て、活性変化を計算している。ここで得られた活性化エンタルピーは平均18kcal/molで,実験より得られている22kcal/molに近い値を得たと述べている。2’水酸基とリン原子との距離の順に、各リボースでの活性変化の計算値と実験値の比較から,距離が8.4Åと近く、計算値と実験値とが近い値をとっているA6のリボースの2’水酸基が、他の2’水酸基に比べて、遷移状態の安定化への影響が大きいと結論づけている。 第三に, -シクロデキストリンを基本構造にもつ人工リボヌクレアーゼの加水分解反応について解析している。リボヌクレアーゼの第2段階目の反応を再現する人工酵素として, -シクロデキストリンを基本構造にもつ人工リボヌクレアーゼの加水分解反応について解析している。リボヌクレアーゼの第2段階目の反応を再現する人工酵素として, -シクロデキストリンのグルコースの6位に2つのイミダゾール基を導入した分子が合成されており、さらに、2つのイミダゾール基の位置関係から,AB,AC,ADの3種の異性体が合成されていると述べている。本論文で, -シクロデキストリンのグルコースの6位に2つのイミダゾール基を導入した分子が合成されており、さらに、2つのイミダゾール基の位置関係から,AB,AC,ADの3種の異性体が合成されていると述べている。本論文で, -シクロデキストリンを基本構造にもつ人工リボヌクレアーゼの加水分解の素反応の反応プロファイルか得られ,反応に適したイミダゾール基と基質分子の相対位置と構造を得て,3種類の人工リボヌクレアーゼの反応プロファイルから得られた活性化エンタルピーは,実験的に碓認されている触媒能の大小関係AB>AC>ADと定性的に一致しているため,詳細な反応メカニズムを原子座標レベルで解明することに成功しており、 -シクロデキストリンを基本構造にもつ人工リボヌクレアーゼの加水分解の素反応の反応プロファイルか得られ,反応に適したイミダゾール基と基質分子の相対位置と構造を得て,3種類の人工リボヌクレアーゼの反応プロファイルから得られた活性化エンタルピーは,実験的に碓認されている触媒能の大小関係AB>AC>ADと定性的に一致しているため,詳細な反応メカニズムを原子座標レベルで解明することに成功しており、 -シクロデキストリンを用いた新たな人工リボヌクレアーゼ等の人工酵素の開発に寄与できると述べている。 -シクロデキストリンを用いた新たな人工リボヌクレアーゼ等の人工酵素の開発に寄与できると述べている。 以上,本論文ではリン酸基の解離・転移反応を触媒する酵素活性部位の修飾による活性の変化について、分子軌道計算を用いて予測するという独創的な手法を開発し,ras p21,G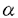 サブユニットのGTPase活性変化の予測,ハンマーヘッド型リボザイムのRNA切断反応モデルのリボース修飾による活性変化の予測, サブユニットのGTPase活性変化の予測,ハンマーヘッド型リボザイムのRNA切断反応モデルのリボース修飾による活性変化の予測, -シクロデキストリンを基本構造にもつ人工リボヌクレアーゼの加水分解反応に適したイミダゾール基と基質分子の複合体構造の予測などに応用し,実験から得られている現象に対する理論的な解釈を与えている。本研究は学術上,応用上,寄与するところが少なくない。よって、審査員一同は,本論文が博士(農学)の学位論文として価値あるものと認めた。 -シクロデキストリンを基本構造にもつ人工リボヌクレアーゼの加水分解反応に適したイミダゾール基と基質分子の複合体構造の予測などに応用し,実験から得られている現象に対する理論的な解釈を与えている。本研究は学術上,応用上,寄与するところが少なくない。よって、審査員一同は,本論文が博士(農学)の学位論文として価値あるものと認めた。 |