筋緊張性ジストロフィー(Dystrophia Myotonica;DM)は、筋緊張、筋萎縮を主症状とし、精神遅滞などの併発を特徴とする常染色体優性の遺伝病である。原因遺伝子はヒトの場合第19番染色体に位置し、DNA配列から蛋白質リン酸化酵素(Myotonin Protein Kinase;MtPK)をコードしていると考えられている。MtPKの3’側の非翻訳領域にはトリプレット・リピート(CTG)nがあり、通常繰り返し数が5-35回であるのに対してDM患者では100-1,000回以上に増幅していることが報告されている。DMは、発現蛋白質は正常であることが予想されるにも関わらず、優性遺伝の形式で発症する大変興味深い遺伝病である。DM発症機構の本質に迫る知見は少なく、現在、その解明に注目が集まっている。本研究は分子生物学的手法を用いてのDM発症機構解明を目的としたもので、三章と総合討論からなる。 第一章はバキュロウイルスによるMtPK発現蛋白の生理作用の追究を行ったものである。ヒトMtPK cDNAをバキュロウイルスに感染させ、MtPK蛋白質を発現させた後、その精製を試みた結果、HiLoadゲル濾過クロマトグラフィーにおいてMtPKは素通り画分に回収された。これはMtPK同士の凝集又はMtPKの膜蛋白質との結合が起こっている可能性を示唆していた。そこでこの素通り画分を、抗MtPK抗体を用いた免疫沈降によって精製し、これを標品として[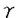 -32P]ATPの取り込みを見たところ、自己リン酸化の活性が観察され、MtPKのリン酸化酵素としての機能が示された。 -32P]ATPの取り込みを見たところ、自己リン酸化の活性が観察され、MtPKのリン酸化酵素としての機能が示された。 第二章は、MtPKの過剰発現によって、転写活性を受ける遺伝子の探索を行ったものである。ヒトMtPKを安定に発現するよう構築した培養細胞系(マウスC2C12株)から全RNAを調製し、Differential Display法を用いたスクリーニングを行ったところ、コントロールに比べ、MtPKの存在下で、転写の活性化が見られる新規の遺伝子を見いだした。この遺伝子をDM-related protein、DMRPと名付け、ヒト、マウス双方から、この遺伝子のクローニングを行った。その結果、DMRPの予想アミノ酸配列中には各種リン酸化酵素によってリン酸化を受けうる部位が存在していた。このため、DMRPはMtPKを介する機構の一部に関与し、シグナルを一方から他方に受け渡す機能を持つ可能性が考えられた。一方ヒト生検筋でのノーザン解析では、DMRPはコントロールに比べて発現量の減少が観察された。これまでにDMに関する多くの矛盾した報告の中で唯一コンセンサスを得ているのは、DM患者筋肉ではMtPK蛋白質の発現量が減少しているというものであるが、この結果は患者でのMtPK蛋白質の減少に伴ってDMRPの発現量も共に減っているものと思われた。 第三章では、MtPKの3’側非翻訳領域に、患者において発症段階の範囲にある、CTG140リピートを保持するクローン取得に成功している。これを用いた、in vitroにおけるmRNAの転写実験では、CTG140リピートを持つMtPKとCAG37リピートを持つTFIIDとを共発現した場合、電気泳動において予想泳動度よりも泳動の遅れが見られ、mRNA同士の会合が起こっていることが示唆された。この現象はMtPKのCTGリピート数が通常型の5と短い場合や、CAGリピート数が22のアンドロジェン・レセプターの場合では起こらず、ここでのmRNA同士の会合は、両遺伝子中のCTCリピート、CAGリピート共にリピート数が長いときのみ起こりうることが示された。 最後に総合討論として、DM発症機構に関する新仮説の提唱をおこなっている。第三章のようにCAGリピートを数十個保持している標的遺伝子の存在を仮定すると、MtPK遺伝子のリピートが正常な範囲の場合は、MtPK、標的遺伝子ともに正常に転写、翻訳され、本来の生理機能を発揮するが、リピートが伸長した場合、MtPKのCTGリピートは、標的遺伝子のCAGリピート部分と相補的な結合を形成し、絡み合うことによって標的遺伝子の蛋白質への翻訳が阻害され、DM発症につながるというのが、この説の概略である。この仮説は、DM患者におけるMtPKの変異が3’側非翻訳領域にあるにも関わらず優性遺伝の形式で発症するという矛盾を説明できるものとして、徒来のDM発症仮説とは一線を画するものである。 以上、本論文はDMの発症機構を分子生物学的手法を用いて追究したものであり、DMに対する治療法の開発への寄与、及び遺伝病に対する新しい概念の確立に、学術上貢献するところが少なくない。よって審査員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 |