脳心筋炎ウイルス(EMCV)はピコルナウイルスに属し、実験医学領域ではウイルス性糖尿病を誘発するウイルスとして注目を集めている。EMCVの変異株の中でも高率に糖尿病を誘発するD株(EMC-D)は、マウスおよびハムスターでは同時に精巣炎を惹起する。ヒトではムンプスウイルス等の感染後に精巣炎の発症が認められるが、ヒト以外の動物でのウイルス性精巣炎の報告は極めて少ない。従って、EMC-D誘発精巣炎はヒトのウイルス性精巣炎のよいモデルであると思われる。申請者の研究の主な目的は、EMC-D接種マウスにおける精巣病変の発現機構を解析し、ウイルス性精巣炎モデル作製の基礎データを得ることである。論文は以下の4章からなる。 第1章では、EMCVによるマウスの精巣炎の概要を把握する目的で、4および8週齢の雄マウスに105PFUのEMC-Dを腹腔内または左精巣内に接種し、7日目まで経時的に検索した。その結果、精上皮の変性・壊死と精細管周囲への好中球浸潤といつた急性病変が認められた。精巣病変の性状については、マウスの週齢および接種経路による差は認められなかったが、発症率および強度に差が認められた。すなわち、腹腔内接種マウスでは、4週齢の方が8週齢マウスよりも発症率が高く、病変も強かった。 第2章では、初期病変の発現機構を解明する目的て、4週齢雄マウスに105PFUのEMC-Dを腹腔内接種し、in situ hybridization(ISH)および電子顕微鏡ISH(ISH-EM)法で7日目まで検索した。接種後2日目に、ごく少数のSertoli細胞でウイルスRNAのシグナルが検出され、その後シグナル陽性のSertoli細胞数は増加した。4日目以降は精細胞や精祖細胞でもシグナルが認められ、退行性変化が認められるようになった。7日目には、精細管の管腔は壊死、脱落した精細胞で閉塞され、周囲には好中球の浸潤が目立った。また、脱落した変性精細胞の細胞質内には直径20-30nmのウイルス様粒子の小集塊が認められた。以上の結果から、血行性に精巣内に達したEMC-Dは最初にSertoli細胞を攻撃し、次いで精細胞や精祖細胞を傷害することが示された。 第3章では、亜急性期に至る病変の推移を明らかにする目的で、4週齢マウスに低用量(10PFU)のEMC-Dを腹腔内接種し、接種後6週目まで観察した。接種後3日目に精上皮にウイルスRNAのシグナルが観察された。7日目には多数のシグナルの発現を伴う精上皮の退行性変化が認められ、精細管周囲にはマクロファージ(M )の浸潤が目立った。また、RT-PCRの結果、iNOSおよびIFN- )の浸潤が目立った。また、RT-PCRの結果、iNOSおよびIFN-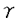 のmRNAの発現量の増加が認められた。M のmRNAの発現量の増加が認められた。M の浸潤は、精上皮の退行性変化が高度になり、ウイルスRNAのシグナルが検出されなくなる3週後まで顕著であった。5週後にはM の浸潤は、精上皮の退行性変化が高度になり、ウイルスRNAのシグナルが検出されなくなる3週後まで顕著であった。5週後にはM に加え、ほぼ同数のCD4およびCD8陽性細胞の浸潤を示す個体が認められた。以上のことから、低用量のEMC-D接種マウスの精巣病変の進展には、M に加え、ほぼ同数のCD4およびCD8陽性細胞の浸潤を示す個体が認められた。以上のことから、低用量のEMC-D接種マウスの精巣病変の進展には、M が関与していることが示された。 が関与していることが示された。 第4章では、EMC-Dの精巣感染における接着因子およびM の関与を確認する目的で、1)抗Mac1およびMac2抗体投与によるM の関与を確認する目的で、1)抗Mac1およびMac2抗体投与によるM 抑制、2)CD4*T細胞抑制、3)抗VCAM-1抗体あるいはICAM-1抗体の精巣内投与による接着因子抑制、をおこなった4週齢雄マウスに10PFUのEMC-Dを接種し、精巣病変の発症状況を観察した。その結果、M 抑制、2)CD4*T細胞抑制、3)抗VCAM-1抗体あるいはICAM-1抗体の精巣内投与による接着因子抑制、をおこなった4週齢雄マウスに10PFUのEMC-Dを接種し、精巣病変の発症状況を観察した。その結果、M 抑制群では、精巣炎の発症およびウイルスRNAのシグナルの発現が顕著に抑制された。また、CD4*T細胞抑制群ではこれらは抑制されなかったが、接着因子抑制群では抑制される傾向を示した。このように、EMC-D接種マウスの精巣病変の発現と進展には、M 抑制群では、精巣炎の発症およびウイルスRNAのシグナルの発現が顕著に抑制された。また、CD4*T細胞抑制群ではこれらは抑制されなかったが、接着因子抑制群では抑制される傾向を示した。このように、EMC-D接種マウスの精巣病変の発現と進展には、M および接着因子が関与していることが示された。 および接着因子が関与していることが示された。 本研究の結果、EMC-D接種マウスでは、ウイルスは血行性に精巣に達し、まずSertoli細胞に感染して同細胞内で増殖し、次いで血液精巣関門を破壊して隣接した精細胞や精祖細胞に伝播することが明らかにされた。また、Sertoli細胞への感染には細胞表面の接着因子がレセプターとして関与している可能性が示唆され、さらに、低用量のEMC-D接種による亜急性精巣病変の進展にはM が関与していることが明らかにされた。以上の結果は、この実験系が人の精巣炎研究の際のモデルとして非常に有用であることを示すもので、実験医学上、極めて重要である。よって審査委員一同は本論文が博士(農学)の学位論文として価値あるものと認めた。 が関与していることが明らかにされた。以上の結果は、この実験系が人の精巣炎研究の際のモデルとして非常に有用であることを示すもので、実験医学上、極めて重要である。よって審査委員一同は本論文が博士(農学)の学位論文として価値あるものと認めた。 |