免疫応答において重要な役割を果たしているT細胞は胸腺内で増殖、分化するが、この過程にはサイトカイン、接着分子、T細胞受容体(TCR)など様々な因子が関わっている。T細胞は胸腺内でCD4-CD8-DN(double negative)からCD4+CD8+DP(double positive)を経てCD4-CD8+SP(single positive)またはCD4+CD8-SPへと分化する。このときT細胞の分化段階によりサイトカイン応答性が異なることが知られている(図1)。最も幼若なDN前期の細胞は多種のサイトカインに応答し、盛んに増殖するが、DP期に近づくにつれ応答性が弱くなり、DP細胞は全くサイトカインに応答しない。DN後期には pre-TCRによる選択が、DP期にはTCRによる選択が行われ、正の選択を受けた細胞はSP細胞へと分化し、TCR刺激とサイトカインの両方に応答し、増殖するようになる。IL-2、IL-7のレセプターではDP期に近づくにつれその発現が低下することが示されているが、他のサイトカインレセプターの発現は不明であり、このサイトカイン応答性の変化の機構は明らかでない。 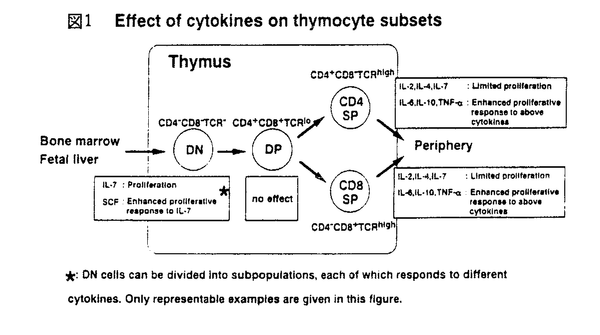 図1 Effect of cytokines on thymocyte subsets 図1 Effect of cytokines on thymocyte subsets 申請者の所属する研究室では数年来、主にミエロイド系細胞の分化と増殖に関与すると考えられているサイトカインである顆粒球マクロファージコロニー刺激因子(GM-CSF)のレセプターとそのシグナル伝達について解析を進めてきた。GM-CSFレセプターはリガンド特異性を決定する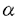 鎖とIL-3、IL-5によって共有される 鎖とIL-3、IL-5によって共有される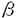 鎖の2本鎖から構成されるが、ヒトGM-CSFレセプター 鎖の2本鎖から構成されるが、ヒトGM-CSFレセプター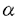 、 、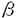 鎖遺伝子を本来このレセプターを発現していないBa/F、CTLL、NIH3T3などの細胞株に導入し細胞膜上で再構成させると、ヒトGM-CSF(hGM-CSF)に応答性の増殖能を獲得した。これはレセプターの発現によりサイトカイン応答性が制御されていることを示唆する。この知見に基づき、個体においてのサイトカインレセプターの発現とサイトカイン応答性の関係を調べるため、hGM-CSFレセプターを恒常的に発現したトランスジェニックマウスが作成された。マウスGM-CSF(mGM-CSF)はhGM-CSFレセプターと反応しないため平常状態ではこのトランスジェニックマウスは正常であり、外部からリガンドを加えることによりレセプターの活性化を人為的に制御することが可能である。私はこのトランスジェニックマウスを用いてT細胞の分化におけるサイトカインレセプターの発現と、サイトカイン応答性の関係の解析を行った。 鎖遺伝子を本来このレセプターを発現していないBa/F、CTLL、NIH3T3などの細胞株に導入し細胞膜上で再構成させると、ヒトGM-CSF(hGM-CSF)に応答性の増殖能を獲得した。これはレセプターの発現によりサイトカイン応答性が制御されていることを示唆する。この知見に基づき、個体においてのサイトカインレセプターの発現とサイトカイン応答性の関係を調べるため、hGM-CSFレセプターを恒常的に発現したトランスジェニックマウスが作成された。マウスGM-CSF(mGM-CSF)はhGM-CSFレセプターと反応しないため平常状態ではこのトランスジェニックマウスは正常であり、外部からリガンドを加えることによりレセプターの活性化を人為的に制御することが可能である。私はこのトランスジェニックマウスを用いてT細胞の分化におけるサイトカインレセプターの発現と、サイトカイン応答性の関係の解析を行った。 胸腺内の各分化段階でのhGM-CSFに対する応答性を調べるため、トランスジェニックマウスの胸腺内T細胞をDN、DP、SPの分画に分け、各々のhGM-CSFまたはmGM-CSF存在下、非存在下でのトリチウムサイミジンの取り込みを調べた。その結果、どの細胞もmGM-CSFには全く応答しなかったが、DN、SP細胞でhGM-CSFに応答した増殖活性が見られた。しかしDP細胞は他の分化段階の細胞と同レベルのhGM-CSFレセプターの発現にもかかわらずhGM-CSFに応答した増殖活性を示さなかった。本来GM-CSFに応答しないDN、SP細胞がhGM-CSFレセプターの強制発現によりhGM-CSF応答性の増殖能を獲得したことは、細胞株での知見と同様、サイトカインレセプターの発現がサイトカイン応答性を制御することを示唆する。しかし、どのサイトカインにも応答しないことが知られているDP細胞はレセプターを強制発現させても増殖能を獲得しなかった。このことは、DP細胞のレセプターの下流の細胞内機構が他の分化段階の細胞と異なることを示唆する。T細胞においてサイトカイン応答性の制御は、その分化段階により、レセプターの発現とその下流の細胞内機構の両方を使い分けていると考えられる。 次にhGM-CSFのT細胞分化に対する影響を、T細胞の分化系である胎児胸腺培養系にhGM-CSFを加えることにより解析した。トランスジェニックマウスと正常マウスの胎生15日胎児胸腺をhGM-CSF存在下、非存在下で培養した結果、トランスジェニックマウスにおいてのみhGM-CSF濃度に依存したDP細胞の減少が見られた。このDP細胞の減少はhGM-CSFがDN細胞からDP細胞への分化を時期特異的に抑制することによると考えられた。すなわち、DN細胞はDP細胞に分化できないが、DP細胞はSP細胞へと分化できるため、分化が進むにつれ、DP細胞が減少する(次ページ図2)。この可能性を検証するため、分化段階の異なる胎児胸腺をhGM-CSF存在下で培養し、その影響の差を調べた。 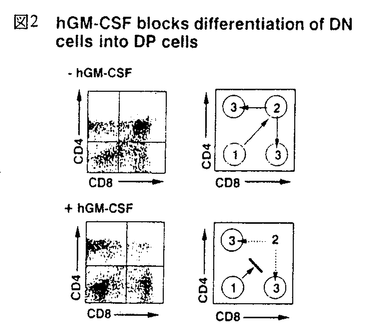 図2 hGM-CSF blocks differentiation of DN cells into DP cells 図2 hGM-CSF blocks differentiation of DN cells into DP cells 最も未熟な胎生14日の胎児胸腺をhGM-CSF存在下で培養するとほとんどDP,SP細胞が見られなくなるが、胎生15日、16日の胎児胸腺では、DP、SP細胞がより多く見られた。これはより胎生の日数が進んだ胎児胸腺にはより分化段階の進んだ細胞が含まれることによる、つまり、hGM-CSFの阻害する時期をすでに通過した細胞が多く含まれることによると考えられ、hGM-CSFがDNの特定時期の分化を阻害することが示唆された。 hGM-CSFはミエロイド系細胞の増殖、分化に関わっていると考えられており、T細胞は本来、GM-CSFには応答しない。このため、この分化阻害はhGM-CSFがT前駆細胞をミエロイド系細胞に分化させていることによる可能性が考えられた。このため、hGM-CSFによる分化阻害後のT前駆細胞がT細胞への分化能を保持しているかどうかを調べた。hGM-CSF存在下で培養し、分化を阻害された胎児胸腺をhGM-CSFを除いてさらに培養すると、分化阻害された細胞は正常にDP、SPへと分化した。このことから、hGM-CSFの作用はT前駆細胞のT細胞への分化能を失わせないことが示唆され、hGM-CSFがT細胞前駆細胞の分化方向に影響を与えている可能性は低いと考えられた。 hGM-CSFによる分化阻害の機構を明らかにするには、分化阻害の時期をより細かく特定することが必要と考えられる。DN細胞はCD44、CD25の発現によりさらに細かい分化段階に分けられ、CD44+CD25-からCD44+CD25+(pro-T)、CD44-CD25+(pre-T)、CD44-CD25-(post-pre-T)の順に分化する(図3)。この過程でT細胞系列への分化の決定時期、TCR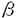 鎖の再構成の行われる時期、pre-TCRによる選択( 鎖の再構成の行われる時期、pre-TCRによる選択(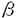 -selection)が行われる時期などが特定されている。hGM-CSFによる分化阻害の時期はどの時期にあたるかを特定することは分化阻害の機構を探る手がかりになると考えられる。このため、特定の分化段階の細胞による胸腺の再構成を行った。トランスジェニックマウスのDN細胞をCD44、CD25の発現をもとにpro-T、pre-T、post-pre-TにFACSソーティングにより分画し、デオキシグアノシン処理により内在性のT細胞を除いた胎児胸腺に導入し、hGM-CSF存在下で培養した。 -selection)が行われる時期などが特定されている。hGM-CSFによる分化阻害の時期はどの時期にあたるかを特定することは分化阻害の機構を探る手がかりになると考えられる。このため、特定の分化段階の細胞による胸腺の再構成を行った。トランスジェニックマウスのDN細胞をCD44、CD25の発現をもとにpro-T、pre-T、post-pre-TにFACSソーティングにより分画し、デオキシグアノシン処理により内在性のT細胞を除いた胎児胸腺に導入し、hGM-CSF存在下で培養した。 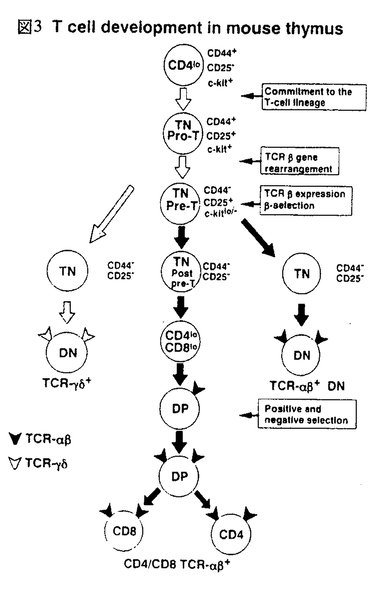 図3 T cell development in mouse thymus 図3 T cell development in mouse thymus このときストロマ細胞上のhGM-CSFレセプターを通し間接的にT細胞に現われる影響を除くため胎児胸腺は正常マウスのものを用いた。pro-T細胞、pre-T細胞を導入した胎児胸腺では培養後も細胞はDNのままであった。これに対し、post-pre-T細胞を導入した胎児胸腺ではDP、SPへの分化が見られた。このことはhGM-CSFがpre-Tからpost-pre-Tへの分化を抑制するが、以後の分化には影響しないことを示している。また、どの細胞を導入した胸腺でもhGM-CSFを加えることにより、細胞数の上昇が見られたことから、これらの細胞が胎児胸腺中でhGM-CSFに応答し増殖することが示唆された。 現在までに、サイトカインの胎児胸腺培養系への添加による分化抑制の報告が、IL-4、IL-7、TGF-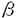 等についてなされているが、その分化抑制の時期は、いずれも幼若なCD44+CD25-とpro-Tの時期である。これらの知見はこの時期の細胞のサイトカイン応答性が高いこととよく一致する。対して、本実験のトランスジェニックマウスでの分化抑制時期は、より分化の進んだpre-Tの時期であった。この時期の細胞は本来ならばサイトカイン応答性が非常に低いが、hGM-CSFレセプタートランスジェニックマウスの細胞ではhGM-CSFによる増殖と分化阻害が見られた。これはレセプターを強制発現したことにより、本来サイトカインシグナルの入らない時期にhGM-CSFのシグナルが細胞に伝えられたことにより、分化が阻害された可能性を示唆する。本要旨の冒頭に挙げたT細胞本来のサイトカイン応答性の分化段階による変化とともに、このトランスジェニックマウスを用いた液体培養系での増殖実験、胎児胸腺培養系での分化実験の結果を総合すると、T細胞の分化においては特定時期にサイトカインによるシグナルを受けないことが重要であり、その制御はDN後期にはレセプターの発現により、DP期には細胞内機構により行われることが考えられる。 等についてなされているが、その分化抑制の時期は、いずれも幼若なCD44+CD25-とpro-Tの時期である。これらの知見はこの時期の細胞のサイトカイン応答性が高いこととよく一致する。対して、本実験のトランスジェニックマウスでの分化抑制時期は、より分化の進んだpre-Tの時期であった。この時期の細胞は本来ならばサイトカイン応答性が非常に低いが、hGM-CSFレセプタートランスジェニックマウスの細胞ではhGM-CSFによる増殖と分化阻害が見られた。これはレセプターを強制発現したことにより、本来サイトカインシグナルの入らない時期にhGM-CSFのシグナルが細胞に伝えられたことにより、分化が阻害された可能性を示唆する。本要旨の冒頭に挙げたT細胞本来のサイトカイン応答性の分化段階による変化とともに、このトランスジェニックマウスを用いた液体培養系での増殖実験、胎児胸腺培養系での分化実験の結果を総合すると、T細胞の分化においては特定時期にサイトカインによるシグナルを受けないことが重要であり、その制御はDN後期にはレセプターの発現により、DP期には細胞内機構により行われることが考えられる。 また、hGM-CSFによる分化阻害の時期は、RAG遺伝子欠損マウスやTCR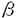 鎖遺伝子欠損マウスなどpre-TCRによる選択( 鎖遺伝子欠損マウスなどpre-TCRによる選択(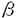 -selection)が正常に行われないことによる分化阻害の時期と一致する。このため、hGM-CSFによる分化阻害とpre-TCRによる分化シグナルとの関連が示唆された。胸腺においてpro-T細胞は盛んに増殖しているが、pre-T細胞はpre-TCRによる選択を受ける際に細胞周期を停止しており、選択を受けると増殖とpost-pre-T細胞への分化が始まることが報告されている。しかし、hGM-CSFレセプタートランスジェニックマウスのpre-T細胞はhGM-CSFに応答し増殖することから、hGM-CSFシグナルによる増殖が分化阻害の原因である可能性が考えられ、現在その可能性を検証中である。このトランスジェニックマウスを用いて、分化と増殖の関連をさらに解析することは興味ある課題である。 -selection)が正常に行われないことによる分化阻害の時期と一致する。このため、hGM-CSFによる分化阻害とpre-TCRによる分化シグナルとの関連が示唆された。胸腺においてpro-T細胞は盛んに増殖しているが、pre-T細胞はpre-TCRによる選択を受ける際に細胞周期を停止しており、選択を受けると増殖とpost-pre-T細胞への分化が始まることが報告されている。しかし、hGM-CSFレセプタートランスジェニックマウスのpre-T細胞はhGM-CSFに応答し増殖することから、hGM-CSFシグナルによる増殖が分化阻害の原因である可能性が考えられ、現在その可能性を検証中である。このトランスジェニックマウスを用いて、分化と増殖の関連をさらに解析することは興味ある課題である。 |