転写因子NFAT(nuclear factor of activated T cells)ファミリーは、サイトカイン遺伝子やその他の免疫調節に関与する遺伝子の発現を制御することにより、免疫反応及び炎症反応において重要な役割を果たしている。NFATの結合部位はインターロイキン(Interleukin;IL)-2、GM-CSF、IL-4、IL-5、TNF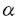 、CD40L、granzyme Bなど複数の遺伝子の発現制御領域に見い出されている。 、CD40L、granzyme Bなど複数の遺伝子の発現制御領域に見い出されている。 T細胞において、NFATは通常リン酸化された状態で細胞質に存在しているが、T細胞受容体を介する刺激に引き続く細胞内カルシウム濃度の上昇に伴い、核内に移行する。NFATの核移行は、カルシウム・カルモジュリン依存性ホスファターゼ、カルシニューリンによる脱リン酸化により引き起こされると考えられている。核内へ移行したNFATは、Ras(PKC)に依存したシグナルにより誘導されるAP-1と複合体を形成してNFAT結合部位に結合し、転写を誘導する。一方、免疫抑制剤であるシクロスポリンA及びFK506はカルシニューリンの活性の抑制を通してNFATの活性化を阻害することが知られている。 近年のcDNAクローニングにより、NFATは複数のファミリーより成ることが明かにされた。現段階でNF-AT1/NF-ATp,NF-AT2/NF-ATc,NF-ATx/NF-AT4/NF-ATc3,NF-AT3の少なくとも4種の存在が知られている。各NFATファミリーメンバーは組織特異的発現を示す。すなわち、NFATp、NFATcは末梢リンパ組織で優位に発現しているのに対し、NFATxは胸腺で強く発現している。また、NFAT3は免疫系以外の組織で高い発現がみられる。これらの事実は、各NFATファミリーメンバーにはある一定の機能分担がある可能性を示唆している。 NFATファミリーには、いくつかの特徴的な構造が共通して存在する。Rel相同領域(Rel homology domain;RHD)は、RelファミリーのDNA結合ドメインと弱い相同性を示し、DNAやAP-1との結合に関与している。このRHDは、NFATファミリー間では、アミノ酸レベルで65%以上の高い相同性を示す。また、NFATホモロジー領域(NFAT homology domain;NHD)と名付けられているN末側の領域には、セリン残基が多く存在し、この領域内でも特にSRRモチーフ、SPボックスにクラスターを成して存在する。これらのモチーフもNFATファミリー間で良く保存されており、カルシウムシグナルによるNFATの核内移行の制御に関与すると考えられている。核移行シグナル(nuclear localization signal;NLS)は、NHD、RHDにそれぞれ1つずつ存在する。 マウスのNFATc(mNFATc)は、部分的なcDNA配列と染色体上の位置が報告されているのみで、NFATファミリーメンバーの中でも比較的解析が遅れていた。このため、本研究では、mNFATcの全長のcDNAを単離してその機能解析を行い、さらに、T細胞及び発生過程における発現パターンについて検討を行った。 ホルボールエステルPhorbol-12-myristate-13-acetate(PMA)で3時間刺激後のリンパ腺腫細胞EL-4から作製したcDNAライブラリーをヒトNFATc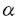 (hNFATc (hNFATc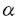 )のcDNAをプローブとしてスクリーニングを行い、3018bpのcDNAを単離した。このcDNAは、718アミノ酸から成るタンパク質をコードしていた。genbankのデータベースにより、このcDNAをホモロジー検索したところ、hNFATcとしては2つのアイソフォームhNFATc )のcDNAをプローブとしてスクリーニングを行い、3018bpのcDNAを単離した。このcDNAは、718アミノ酸から成るタンパク質をコードしていた。genbankのデータベースにより、このcDNAをホモロジー検索したところ、hNFATcとしては2つのアイソフォームhNFATc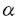 、hNFATc 、hNFATc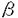 の存在が明かにされているが、そのうちのhNFATc の存在が明かにされているが、そのうちのhNFATc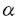 と高い相同性を示すことが判明し(ヌクレオチドレベルで83%、アミノ酸レベルで87%同一)、このcDNAが、hNFATc と高い相同性を示すことが判明し(ヌクレオチドレベルで83%、アミノ酸レベルで87%同一)、このcDNAが、hNFATc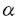 のマウスにおけるホモログをコードしていることが示唆された。mNFATcは、NFATファミリー間で保存されている構造モチーフ、RHD、NLS、SRRモチーフ、SPボックスを含んでおり、mNFATcのRHDの相同性はhNFATc のマウスにおけるホモログをコードしていることが示唆された。mNFATcは、NFATファミリー間で保存されている構造モチーフ、RHD、NLS、SRRモチーフ、SPボックスを含んでおり、mNFATcのRHDの相同性はhNFATc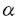 、hNFATc 、hNFATc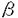 、他のNFATファミリーメンバーのRHDとそれぞれ96%、94%、65-89%であった。 、他のNFATファミリーメンバーのRHDとそれぞれ96%、94%、65-89%であった。 次に、このmNFATcのDNA結合能及び転写活性化能について検討した。COS-7細胞でmNFATcを発現させ、細胞抽出液を用いてゲルシフトアッセイを行ったところ、mNFATcのIL-2プロモーターのNFAT結合部位への結合が検出された。さらに、NFAT結合部位あるいはAP-1結合部位を含むオリゴヌクレオチドを用いた競合実験により、mNFATcは単独では結合せず、AP-1と複合体を形成して結合することが示された。転写活性化については、mNFATcの発現プラスミドとIL-2プロモーターを含むレポータープラスミドをCOS-7細胞に一過性に導入する実験により、mNFATcはIL-2プロモーター活性を上昇させることを確認した。 ヒトT細胞において、NFATファミリーメンバーは異なる発現誘導パターンを示すことが示されている。すなわち、hNFATcの発現は刺激に依存しているが、その他のファミリーメンバーは構成的に発現している。そこで、マウスにおいても、同じ現象がみられるかについて検討を行った。まず、mNFATcのcDNAをプローブとして、EL-4細胞を用いたノーザン解析を行ったところ、mNFATcのmRNA産生はPMAにより誘導された。未刺激の細胞では、mNFATcのmRNAはほとんど検出されなかったのに対し、PMAで刺激を行うと、3時間後には検出され、6時間後にピークに達した。一方、mNFATpの転写産物は刺激前から存在しており、その量は刺激により非常にわずかにしか増加しなかった。mNFATxのmRNA産生も構成的で、刺激による変化はみられなかった。以上の結果より、マウスNFATファミリーメンバーの発現誘導パターンとヒトNFATファミリーメンバーの発現誘導パターンが非常に類似していることが示された。また、mNFATcの組織における発現についても調べたところ、mNFATcのmRNAは脾臓、肝臓、腎臓、骨格筋、心臓、肺などの多くの組織で検出された。 最後に、マウスの発生過程におけるNFATファミリーの発現パターンについて以下の解析を行った。マウスの全胚から抽出したRNAを用いて、NFATファミリーメンバーのノーザン解析を行ったところ、胎仔肝、血球系細胞、胸腺が分化する以前の胎生7日目には、すでにmNFATc、mNFATp、mNFATx全ての発現が検出された。mNFATc、mNFATp、mNFATxは全てマウスの発生過程を通して発現していたが、その時間的な発現パターンはそれぞれで異なっていた。mNFATcは胎生7日目で低レベル発現しており、胎生11日目でわずかな減少がみられ、それ以後胎生17日目まで継続的に増加した。mNFATpの発現は胎生7日目から胎生17日目にかけて継続的に上昇した。mNFATxの発現は、それとは対照的に、胎生7日目から胎生17日目まで継続的に低下した。さらに、胎生17日目のマウス胚を用いてin situハイブリダイゼーションを行い、mNFATcのマウス胚における組織発現について検討した。その結果、mNFATcの転写産物は、胸腺、肺、顎下腺に強く発現しており、骨格筋と心臓に弱く発現していることが示された。以上の結果より、mNFATcが成熟T細胞の活性化においてのみならず、マウスの発生過程においても何らかの役割を果たしていることが示唆された。 現在までに、少なくとも4つのNFATファミリーメンバーと各メンバーについて数種類のスプライシングによるアイソフォームが同定されているが、その各々がもつ生理学的意義については今だ明かではない。本研究で得られた、NFATファミリーメンバーのマウスの胚期及び成体における組織分布についての結果は、それぞれのメンバーが固有の役割を果たしていることを強く示唆している。そのような観点から、Parkらが報告した、NFATc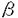 がIL-2プロモーターを活性化するのに対してTNF がIL-2プロモーターを活性化するのに対してTNF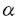 プロモーターは活性化し得ないという事実は注目に値する。マウスの胚及び胸腺の分化におけるmNFATcの発現パターンについてのさらなる解析はmNFATcのもつ生理学的意義の解明に手がかりを与えると思われる。 プロモーターは活性化し得ないという事実は注目に値する。マウスの胚及び胸腺の分化におけるmNFATcの発現パターンについてのさらなる解析はmNFATcのもつ生理学的意義の解明に手がかりを与えると思われる。 |