本研究は、膵臓外分泌腺細胞においてアゴニスト刺激で引き起こされるCa2+濃度の上限を正確に測定するため、低親和性Ca2+指示薬であるベンゾチアゾールクマリン(BTC)を用いて二波長励起Ca2+画像解析を行い、また膵臓外分泌腺細胞のCa2+シグナルと細胞機能との関係を検討したものであり、下記の考察と結果を得ている。 1.《Ca2+画像解析におけるキャリブレーション》 これまでの実験系において使用されてきたfura-2などのCa2+指示薬はCa2+に対する親和性が高く、測定するCa2+濃度が大きくなるにつれ正確なCa2+濃度測定が困難であった。なぜならば、得られたレシオ(R)を[Ca2+]1=Kd’(R-Rmin)/(Rmax-R)というGrynkiewicz,Poenie,Tsienの式(JBC、1985)でCa2+濃度に換算する際には、Ca2+濃度が高いと分母である(Rmax-R)の項が0に近づくので正確にRmaxを求める必要があるが、Rmax、Rmin、Kd’などの定数は電解質液中と細胞内で異なることから細胞内でキャリブレーションを行わねばならず、この際Rmaxはそもそも求め難い定数であるのに加え、細胞内のばらつきも大きい。したがってfura-2などの高親和性Ca2+指示薬で求めたのでは2〜3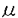 M以上のCa2+測定には信頼性がない。今回低親和性Ca2+指示薬BTCを用いたことにより生理的条件下でRがRmaxに近づくことはなく、Rmaxの測定誤差がCa2+濃度推定に与える影響は少なく、より高いCa2+濃度を測定することが可能となった。 M以上のCa2+測定には信頼性がない。今回低親和性Ca2+指示薬BTCを用いたことにより生理的条件下でRがRmaxに近づくことはなく、Rmaxの測定誤差がCa2+濃度推定に与える影響は少なく、より高いCa2+濃度を測定することが可能となった。 2.《マイクロモーラーCa2+スパイク》 単離腺細胞にアゴニストとして高濃度のACh(1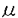 M)を投与すると、腺腔端のいわゆるトリガー領域に始まるCa2+波動が観察され、トリガー領域においてはCa2+濃度の最大値が約10 M)を投与すると、腺腔端のいわゆるトリガー領域に始まるCa2+波動が観察され、トリガー領域においてはCa2+濃度の最大値が約10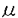 Mに達することが示された(マイクロモーラーCa2+スパイク)こうして得られたCa2+画像は、Ca2+波動の全時間経過を通じて腺腔端のトリガー領域におけるCa2+濃度が他の領域より高く、またトリガー領域における強いCa2+上昇はアゴニストを投与し続けているのにも関わらず一過性であり、数秒後には刺激前のレベルに回復する、という特徴をもっていた。一方fura-2を用いたCa2+画像解析ではこれらの特徴が観察されなかった。 Mに達することが示された(マイクロモーラーCa2+スパイク)こうして得られたCa2+画像は、Ca2+波動の全時間経過を通じて腺腔端のトリガー領域におけるCa2+濃度が他の領域より高く、またトリガー領域における強いCa2+上昇はアゴニストを投与し続けているのにも関わらず一過性であり、数秒後には刺激前のレベルに回復する、という特徴をもっていた。一方fura-2を用いたCa2+画像解析ではこれらの特徴が観察されなかった。 3.《二色素四波長励起Ca2+画像解析》 同じ細胞にBTCとfura-2を同時に投与して二色素四波長励起画像解析をおこなったところ、やはりBTC画像のみにマイクロモーラーCa2+スパイクが観察された。この結果により、上記の二つの色素間で生じた差異は色素の親和性の差によるものであることが示唆され、また、fura-2が飽和するような大きなCa2+上昇が起きているということが強く支持された。 低濃度のアゴニストを投与した場合(50nMのACh)では、fura-2による画像解析ではトリガー領域から立ち上がり、基底領域に伝播していくCa2+波動を示したが、BTCによるCa2+画像解析ではほとんど変化が見られなかった。この結果から膵臓外分泌腺細胞ではアゴニストの濃度が低いと1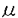 Mに達しない小さなCa2+上昇(サブマイクロモーラーCa2+スパイク)が起きることが二色素四波長励起画像解析によって初めて見出された。 Mに達しない小さなCa2+上昇(サブマイクロモーラーCa2+スパイク)が起きることが二色素四波長励起画像解析によって初めて見出された。 4.《開口放出のCa2+親和性》 膜容量測定法とケイジド試薬を組み合わせて開口放出におけるCa2+親和性を求めたところ、膵臓外分泌腺細胞には異なる速度で分泌される二種類の開口放出が存在した。すなわちCa2+濃度上昇が5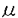 Mを超えて初めて観察される、遅延を持った遅い膜容量増大と、さらに大きなCa2+濃度上昇(約10 Mを超えて初めて観察される、遅延を持った遅い膜容量増大と、さらに大きなCa2+濃度上昇(約10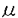 M)を与えたときに観察された、速い膜容量増大成分であった。今回この膜容量測定法で得られた遅い開口放出のCa2+依存性は、streptolysin-Oなどで膜を透過型にした実験系において、amylase分泌には3 M)を与えたときに観察された、速い膜容量増大成分であった。今回この膜容量測定法で得られた遅い開口放出のCa2+依存性は、streptolysin-Oなどで膜を透過型にした実験系において、amylase分泌には3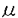 M以上のCa2+上昇が必要であるという結論と一致し、whole-cell clampのような生理的状態に近い細胞においても、分泌顆粒の開口放出は低親和性であることが示された。 M以上のCa2+上昇が必要であるという結論と一致し、whole-cell clampのような生理的状態に近い細胞においても、分泌顆粒の開口放出は低親和性であることが示された。 5.《Ca2+スパイクと細胞生理機能》 これらのCa2+上昇が膵臓外分泌腺細胞のもつ二つのCa2+依存性の細胞機能、つまり膜融合による酵素分泌とCa2+依存性チャネルの活性化による電解質輸送との対応を検討するために、膜容量測定とBTCを用いたCa2+画像解析を同時に行うことによって調べた。その結果、高濃度のACh(1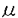 M)を投与し、トリガー領域でのCa2+濃度が10 M)を投与し、トリガー領域でのCa2+濃度が10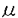 Mに達するような場合には大きな膜容量変化がすぐに観察された。これに対し、低濃度のACh(50nM)を投与した場合では、トリガー領域のCa2+濃度上昇が5 Mに達するような場合には大きな膜容量変化がすぐに観察された。これに対し、低濃度のACh(50nM)を投与した場合では、トリガー領域のCa2+濃度上昇が5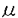 Mに達しないときには膜容量変化は起こらなかった。しかし低濃度のAChで刺激し、Ca2+濃度が1 Mに達しないときには膜容量変化は起こらなかった。しかし低濃度のAChで刺激し、Ca2+濃度が1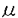 Mに達しない時においても大きな二相性のCl-電流は活性化された。第一相の一過性の電流はトリガー領域にCa2+濃度上昇が観察されると同時に現れ、二相目の電流はCa2+波動が基底側に広がって初めて現れ、いわゆるpush-pull機構によって電解質輸送が起こることを追認した。 Mに達しない時においても大きな二相性のCl-電流は活性化された。第一相の一過性の電流はトリガー領域にCa2+濃度上昇が観察されると同時に現れ、二相目の電流はCa2+波動が基底側に広がって初めて現れ、いわゆるpush-pull機構によって電解質輸送が起こることを追認した。 以上本論文は、今までは非生理的だと考えられがちであった10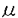 M以上に達するCa2+上昇が上皮細胞のような細胞でも起こり、その場合でも合目的的にCa2+濃度勾配が保たれ、開口放出のスイッチングを行っていることが明らかにした。また膵臓外分泌腺細胞にはマイクロモーラーCa2+スパイクとサブマイクロモーラーCa2+スパイクという少なくとも二種類のCa2+スパイクが存在し、各々開口放出と電解質輸送という異なる細胞機能を選択的に調節していることが初めて明らかにした。本研究は膵臓外分泌腺細胞のCa2+シグナルと細胞機能との関係の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 M以上に達するCa2+上昇が上皮細胞のような細胞でも起こり、その場合でも合目的的にCa2+濃度勾配が保たれ、開口放出のスイッチングを行っていることが明らかにした。また膵臓外分泌腺細胞にはマイクロモーラーCa2+スパイクとサブマイクロモーラーCa2+スパイクという少なくとも二種類のCa2+スパイクが存在し、各々開口放出と電解質輸送という異なる細胞機能を選択的に調節していることが初めて明らかにした。本研究は膵臓外分泌腺細胞のCa2+シグナルと細胞機能との関係の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |