シナプス伝達効率の可塑的変化である長期増強(LTP)、長期抑圧(LTD)は記憶や学習の細胞レベルでのモデルと考えられている。LTP、LTDの研究は海馬のCA1領域において活発に行われており、イオン透過型グルタミン酸受容体の一種であるN-methyl-D-aspartate(NMDA)受容体の活性化に引き続くシナプス後細胞内機構によって誘導されることが広く知られている。一方、海馬の苔状線維-CA3間シナプスのLTPは、CA1領域とは全く異なり、NMDA受容体非依存性で、シナプス前細胞内で誘導されることが報告されている。このシナプスではこれまでLTDの報告が無かったが、本研究によってその存在が見出された。このLTDの性質を詳しく検討した結果、NMDA受容体非依存性で、シナプス前機構によって誘導される新たなタイプのLTDであることが明らかになった。さらに、このLTDの誘発にはシナプス前終末端の代謝型グルタミン酸受容体(mGluR)とCa2+依存性タンパクリン酸化酵素の活性化が必要であることが示された。 マウスの海馬より作製した厚さ400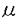 mのスライス標本を実験に用いた。歯状回の顆粒細胞層に刺激電極を刺入し顆粒細胞を電気刺激によって興奮させた。顆粒細胞の軸索である苔状線維とCA3錐体細胞がシナプスを形成している透明層に記録電極を刺入し、苔状線維-CA3錐体細胞間シナプスにおける興奮性シナプス後電位(EPSP)を細胞外記録した。通常は0.1Hzの頻度で刺激を与え、EPSPが少なくとも20-30分間安定に記録されていることを確認した後に、15分間刺激頻度を1Hzに上昇させた。1Hz刺激の間EPSPは5倍程度に増強したが、刺激頻度を0.1Hzに戻すとEPSPの振幅は1Hz刺激以前よりも減少し、約20%減少したレベルで1時間以上安定した。このように、15分間の1Hz刺激によってCA3領域においてもLTDが誘発されることが明らかになった。 mのスライス標本を実験に用いた。歯状回の顆粒細胞層に刺激電極を刺入し顆粒細胞を電気刺激によって興奮させた。顆粒細胞の軸索である苔状線維とCA3錐体細胞がシナプスを形成している透明層に記録電極を刺入し、苔状線維-CA3錐体細胞間シナプスにおける興奮性シナプス後電位(EPSP)を細胞外記録した。通常は0.1Hzの頻度で刺激を与え、EPSPが少なくとも20-30分間安定に記録されていることを確認した後に、15分間刺激頻度を1Hzに上昇させた。1Hz刺激の間EPSPは5倍程度に増強したが、刺激頻度を0.1Hzに戻すとEPSPの振幅は1Hz刺激以前よりも減少し、約20%減少したレベルで1時間以上安定した。このように、15分間の1Hz刺激によってCA3領域においてもLTDが誘発されることが明らかになった。 このLTDは1Hz刺激を与えた入力に特異的に誘導された。1Hz刺激をくり返し与えると、LTDの大きさは徐々に減少し、約50%程度に抑制されたレベルで飽和した。刺激頻度を5-10Hzにすると、1Hz刺激と同じ900回の刺激によってLTPが誘発された。さらに、LTD誘発後に高頻度刺激(100Hz、1s、x2)を与えるとLTPが誘発された。これらの性質はLTDが頻回刺激を与えたことによるシナプスの損傷ではなく、シナプス可塑性であることを示している。 LTDの誘導に対するグルタミン酸受容体の関与をサブタイプ特異的アンタゴニストを用いて検討した。NMDA受容体のアンタゴニストD-APV(25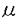 M)の投与下でもLTDは正常に誘導されたが、mGluRアンタゴニストである(+)-MCPG(1mM)の投与によってLTDは強く阻害された。従ってLTDの誘導にはmGluRが必要であることが示唆された。 M)の投与下でもLTDは正常に誘導されたが、mGluRアンタゴニストである(+)-MCPG(1mM)の投与によってLTDは強く阻害された。従ってLTDの誘導にはmGluRが必要であることが示唆された。 次にLTDの誘導にシナプス後細胞の脱分極が関与するかどうかを検討した。L型膜電位依存性Ca2+チャネルの阻害剤、ニカルジピン(10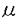 M)存在下でもLTDは正常に誘導された。イオン透過型グルタミン酸受容体を全て抑制するキヌレン酸を高濃度(20mM)投与しEPSPを完全に抑制した状態で1Hzの刺激を行った。1Hz刺激中もEPSPは全く観察されなかったが、キヌレン酸を洗い流すとLTDは正常に誘導されていた。これらの結果はLTDの誘導にはシナプス後細胞の脱分極もイオン透過型グルタミン酸受容体の活性化も必要ではないことを示しており、LTDがシナプス前性に誘導されることを示唆する。 M)存在下でもLTDは正常に誘導された。イオン透過型グルタミン酸受容体を全て抑制するキヌレン酸を高濃度(20mM)投与しEPSPを完全に抑制した状態で1Hzの刺激を行った。1Hz刺激中もEPSPは全く観察されなかったが、キヌレン酸を洗い流すとLTDは正常に誘導されていた。これらの結果はLTDの誘導にはシナプス後細胞の脱分極もイオン透過型グルタミン酸受容体の活性化も必要ではないことを示しており、LTDがシナプス前性に誘導されることを示唆する。 mGluRには8種類のサブタイプが存在する。LTD誘導に関与するmGluRサブタイプを同定するため、mGluR2を欠損したマウスを用いて実験を行った。苔状線維シナプスにおいて、mGluR2はシナプス前部にのみ発現することが知られている。mGluR2欠損マウスでは0.1Hzで刺激した際のシナプス応答には明らかな異常は見られなかったが、mGluR2(及びmGluR3)の特異的アゴニストDCG-IV(0.1-1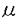 M)の投与によるシナプス抑制が50%程度に減少していた。LTD誘発のため1Hz刺激を与えたところ、1Hz刺激中のシナプス応答は正常であったが、1Hz刺激後のLTDは顕著に減弱していた。従って、LTDの誘導にはシナプス前部に存在するmGluR2が必要であることが明らかになった。これらの結果はLTDがシナプス前性に誘導されることをさらに強く支持する。 M)の投与によるシナプス抑制が50%程度に減少していた。LTD誘発のため1Hz刺激を与えたところ、1Hz刺激中のシナプス応答は正常であったが、1Hz刺激後のLTDは顕著に減弱していた。従って、LTDの誘導にはシナプス前部に存在するmGluR2が必要であることが明らかになった。これらの結果はLTDがシナプス前性に誘導されることをさらに強く支持する。 次にmGluRの活性化のみによってLTDが誘発されるかどうかを検討した。サブタイプ非選択的なmGluRアゴニスト、1S,3R-ACPD(10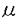 M)を15分間投与した。この濃度のACPDはシナプス伝達を80%以上抑制し、しばしば神経細胞の同期的な発火を引き起こした。この同期的発火による二次的な効果を避けるため、低濃度のキヌレン酸(1-2mM)を同時に投与した。さらに、mGluRの活性化とシナプス活動の相互作用を避けるため、ACPD投与中は刺激を中断した。ACPD及びキヌレン酸を洗い流した後に刺激を再開すると、EPSPの振幅は徐々に投与前の大きさにまで回復しLTDは誘発されなかった。DCG-IVを用いた場合にも同様の結果が得られた。従って、LTDの誘導にはmGluRの活性化以外に1Hz刺激中の何らかの活動が必要であることが示された。シナプス伝達をキヌレン酸によって抑制した状態でもLTDは正常に誘導されたので、シナプス前終末端の活動が必要であると考えられる。 M)を15分間投与した。この濃度のACPDはシナプス伝達を80%以上抑制し、しばしば神経細胞の同期的な発火を引き起こした。この同期的発火による二次的な効果を避けるため、低濃度のキヌレン酸(1-2mM)を同時に投与した。さらに、mGluRの活性化とシナプス活動の相互作用を避けるため、ACPD投与中は刺激を中断した。ACPD及びキヌレン酸を洗い流した後に刺激を再開すると、EPSPの振幅は徐々に投与前の大きさにまで回復しLTDは誘発されなかった。DCG-IVを用いた場合にも同様の結果が得られた。従って、LTDの誘導にはmGluRの活性化以外に1Hz刺激中の何らかの活動が必要であることが示された。シナプス伝達をキヌレン酸によって抑制した状態でもLTDは正常に誘導されたので、シナプス前終末端の活動が必要であると考えられる。 苔状線維終末内のCa2+濃度は1Hz刺激中に上昇することが報告されているのでLTD誘導に対するCa2+の関与を検討した。細胞膜透過型Ca2+キレート剤、BAPTA-AMを用いて細胞内のCa2+濃度上昇を阻害することを試みた。BAPTA-AM(50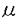 M)を30-50分間潅流投与するとEPSPが40%程度に減少した。刺激強度を上げてEPSPの大きさがBAPTA-AM投与前と同程度になるようにしてから1Hz刺激を与えると、通常の半分以下の大きさのLTDが誘発された。従って、LTDの誘導には細胞内のCa2+濃度上昇が関与すると考えられる。細胞内へのCa2+流入量を操作し、LTDのCa2+依存性をさらに検討した。刺激頻度を0.1Hzに保ったまま、細胞外液のCa2+濃度を通常の2.5mMから5.0mMに、Mg2+濃度を1.3mMから0.5mMにしてCa2+流入量を増加させた。この高Ca2+低Mg2+液の投与中EPSPは増強し、15分間の投与後に通常の細胞外液に戻すとEPSPは徐々に減少し抑制程度が約10%のLTDが誘発された。従って、1Hz刺激はLTD誘発に必須ではなくCa2+の流入量を増加させることで代用可能であると考えられる。これらの結果からシナプス前終末端内Ca2+濃度の上昇がLTD誘導に関与することが示唆された。 M)を30-50分間潅流投与するとEPSPが40%程度に減少した。刺激強度を上げてEPSPの大きさがBAPTA-AM投与前と同程度になるようにしてから1Hz刺激を与えると、通常の半分以下の大きさのLTDが誘発された。従って、LTDの誘導には細胞内のCa2+濃度上昇が関与すると考えられる。細胞内へのCa2+流入量を操作し、LTDのCa2+依存性をさらに検討した。刺激頻度を0.1Hzに保ったまま、細胞外液のCa2+濃度を通常の2.5mMから5.0mMに、Mg2+濃度を1.3mMから0.5mMにしてCa2+流入量を増加させた。この高Ca2+低Mg2+液の投与中EPSPは増強し、15分間の投与後に通常の細胞外液に戻すとEPSPは徐々に減少し抑制程度が約10%のLTDが誘発された。従って、1Hz刺激はLTD誘発に必須ではなくCa2+の流入量を増加させることで代用可能であると考えられる。これらの結果からシナプス前終末端内Ca2+濃度の上昇がLTD誘導に関与することが示唆された。 次に細胞内の酵素の関与を検討した。タンパクリン酸化酵素の非特異的阻害剤H-7(100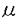 M)はLTDの誘導を阻害した。H-7はDCG-IVによってmGluRを活性化した際のシナプス抑制には影響を及ぼさなかった。細胞内におけるCa2+の作用を仲介するカルモジュリンの阻害剤、カルミダゾリウム(3 M)はLTDの誘導を阻害した。H-7はDCG-IVによってmGluRを活性化した際のシナプス抑制には影響を及ぼさなかった。細胞内におけるCa2+の作用を仲介するカルモジュリンの阻害剤、カルミダゾリウム(3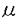 M)によってLTDは強く抑制された。さらに、Ca2+依存性リン酸化酵素の一つカルモジュリンキナーゼの特異的な阻害剤、KN-62(3.5 M)によってLTDは強く抑制された。さらに、Ca2+依存性リン酸化酵素の一つカルモジュリンキナーゼの特異的な阻害剤、KN-62(3.5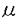 M)はLTDの大きさを2分の1程度に減少させた。以上の結果から、LTDの誘発にはmGluRの活性化に加えて、Ca2+依存性リン酸化酵素が必要であると結論した。 M)はLTDの大きさを2分の1程度に減少させた。以上の結果から、LTDの誘発にはmGluRの活性化に加えて、Ca2+依存性リン酸化酵素が必要であると結論した。 |