本研究は、個体で記憶,学習などの脳の高次機能を解析することを目的として、マウス胚性幹細胞を使って、部位特異的標的遺伝子組み換え法の開発と、それに伴う終脳特異的細胞接着分子テレンセファリンの生理機能解析を試みたものであり、下記の結果を得ている。 1. テレンセファリン(TLN)遺伝子にCre遺伝子組み換え蛋白を挿入し、TLNのメチオニンを含むエキソンのメチオニン以下82bpとそれに続くイントロンの1部(70bp)を欠失させる構造のターゲティングベクターを作製し、TT2胚性幹細胞(ES細胞)に導入し、相同組み換え法によりTLN遺伝子の一部を欠失し、Cre遺伝子組み換え蛋白を発現するマウスを作製した。 2. ゲノム中にCre遺伝子組み換え蛋白の認識するloxP配列を有するGluR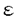 2d2マウスとかけ合わせ、サザンブロットハイブリダイゼーションによりCre遺伝子組み換え蛋白の活性を判定した。その結果、マウス終脳でほぼ100%という高い効率でCre遺伝子組み換え蛋白によるloxP配列間の欠失がみられた。しかし、残念ながら胎生13日の時点ですでに全身でほぼ100%の欠失が認められていた。その理由としてTLN遺伝子にCre遺伝子組み換え蛋白を挿入したES細胞内で、Cre遺伝子組み換え蛋白による組み換えが起こったので、器官が分化する以前の発生の初期段階でTLNが非常に弱く発現していて、その結果として全身でCre遺伝子組み換え蛋白が機能した可能性がある。また、ターゲティングベクターを構築する際、イントロンの一部を欠失させる構築としたために、欠失させた領域内に調節領域が存在していて、発現領域が変化して終脳特異的な発現を示さなかった可能性がある。また、ネオマイシン耐性遺伝子の上流に位置するpgkプロモーターがTLNプロモーターを干渉した可能性もある。 2d2マウスとかけ合わせ、サザンブロットハイブリダイゼーションによりCre遺伝子組み換え蛋白の活性を判定した。その結果、マウス終脳でほぼ100%という高い効率でCre遺伝子組み換え蛋白によるloxP配列間の欠失がみられた。しかし、残念ながら胎生13日の時点ですでに全身でほぼ100%の欠失が認められていた。その理由としてTLN遺伝子にCre遺伝子組み換え蛋白を挿入したES細胞内で、Cre遺伝子組み換え蛋白による組み換えが起こったので、器官が分化する以前の発生の初期段階でTLNが非常に弱く発現していて、その結果として全身でCre遺伝子組み換え蛋白が機能した可能性がある。また、ターゲティングベクターを構築する際、イントロンの一部を欠失させる構築としたために、欠失させた領域内に調節領域が存在していて、発現領域が変化して終脳特異的な発現を示さなかった可能性がある。また、ネオマイシン耐性遺伝子の上流に位置するpgkプロモーターがTLNプロモーターを干渉した可能性もある。 3. 終脳特異的細胞接着分子TLNはin vitroの実験より、神経突起伸長、シナプスの可塑性、ミクログリアで発現がみられるLFA-1との相互作用に関与していることが示唆されたので、TLNの生理機能を解析するためにCre遺伝子組み換え蛋白発現マウスのホモ接合体を作製することによってTLN欠損マウスを作製した。 4. TLN欠損マウス(TLN-/-)には外見上特に異常を認めなかった。Nissl染色により終脳内各領域の形態を光顕レベルで解析したが、TLN-/-マウスは形態的異常を示さなかった。また、対側大脳皮質にビオシチンを注入することにより、逆行性に大脳皮質II/III層に分布する錐体細胞の細胞体、樹状突起を染色し、個々の樹状突起の形態の解析を行ったが、TLN+/+マウスとTLN-/-マウスで差は認められなかった。また、電顕による海馬CA1のシナプス密度の解析、大脳皮質バレル構造の解析の結果、TLN-/-マウスで異常はみられなかった。以上のように、TLN欠損マウスで発生、形態異常は認められなかった。また、TLNの発現のみられる海馬でのシナプス可塑性を評価するために、海馬CA1領域でのシナプス伝達長期増強(LTP)を調べた。その結果TLN+/+マウスとTLN-/-マウスで同程度のLTPが認められた。また、活性化ミクログリアで発現しているLFA-1とニューロンで発現しているTLNの相互作用を調べるために、大脳皮質に寒冷損傷を与え、活性化ミクログリアのニューロンへの遊走を調べたが、TLN+/+マウスとTLN-/-マウスで同様に遊走がみられた。in vitroの結果とin vivoでの結果に違いがみられたが、その理由としてまだ未知のTLN以外の樹状突起に発現がみられる細胞接着分子が機能を代償している可能性が考えられる。 5. 次に生後35-40日のTLN+/+マウスとTLN-/-マウスを用いてopen field testを行い自発運動量の測定を行った。TLN-/-マウスは歩行距離が有意に長く(t検定で危険率0.05以下)、水平方向の活動性が亢進していた。また、立ち上がり回数も有意に多く(t検定で危険率0.05以下)、垂直方向の活動性も亢進していた。このことよりTLNは自発運動の制御に関わっていることが示唆された。 以上、本論文では相同組み換え法によりTLN遺伝子欠損マウスを作製し解析した結果、TLNが生体内で自発運動の調節に役割を果たしていることを見いだした。本研究は終脳特異的細胞接着分子テレンセファリンの生理機能の解明に貢献をなすと考えられ、学位の授与に値するものと考えられる。 |