食細胞は、微生物感染に対する防御の第一線で活躍する細胞で、細静脈から感染の場に遊走し細菌や真菌を取り込み、ファゴソームに活性酸素や顆粒内容物を放出し殺菌する。そのため、その機能に異常が生じると、重篤な細菌や真菌の感染を繰り返すことになる。CD18(インテグリン 鎖)が欠損し、食細胞が血管外に遊走できない白血球粘着不全症や活性酸素産生不全のため殺菌能が低下する慢性肉芽腫症がその代表例である。食細胞が遊走、食作用、脱顆粒などの活動をする場合、細胞内で細胞骨格の急激な再構成が起き、その中でアクチンは中心的な役割をしている。 鎖)が欠損し、食細胞が血管外に遊走できない白血球粘着不全症や活性酸素産生不全のため殺菌能が低下する慢性肉芽腫症がその代表例である。食細胞が遊走、食作用、脱顆粒などの活動をする場合、細胞内で細胞骨格の急激な再構成が起き、その中でアクチンは中心的な役割をしている。 アクチンは酵母をはじめ、真核生物のすべての細胞に存在し、重合・脱重合を繰り返す細胞骨格の主要構成成分の一つである。細胞分裂時にアクチンは細胞質の分裂を引き起こす収縮環を形成し、細胞の変形、運動、接着、などにも直接関与する。また、そのアミノ酸配列は種を越えて高度に保存されている。例えば、酵母アクチンとヒト -アクチン間にも88%の相同性が認められている。長い進化の過程を経ても、高度にそのアミノ酸配列が保存されていること及び多数のアクチン結合タンパク質が存在することは、アクチン自身の重合や他のタンパク質との相互作用に、保存された配列が必須であることを示している。ヒトを含むほ乳類におけるアクチン遺伝子は非筋肉アクチン遺伝子2個、筋肉アクチン遺伝子4個の計6個からなっている。非筋肉アクチンの -アクチン間にも88%の相同性が認められている。長い進化の過程を経ても、高度にそのアミノ酸配列が保存されていること及び多数のアクチン結合タンパク質が存在することは、アクチン自身の重合や他のタンパク質との相互作用に、保存された配列が必須であることを示している。ヒトを含むほ乳類におけるアクチン遺伝子は非筋肉アクチン遺伝子2個、筋肉アクチン遺伝子4個の計6個からなっている。非筋肉アクチンの -, -,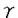 -アクチンは、あらゆる細胞に発現しており、進化的には筋肉アクチンより古い。 -アクチンは、あらゆる細胞に発現しており、進化的には筋肉アクチンより古い。 当教室の布井らは、発熱を伴う感染を繰り返す14才の女子の患者で、好中球の機能異常を見いだしたが、この患者では同時に日光過敏、精神発達遅延が認められた。私は患者好中球の活性酸素産生能低下と同様の現象を、患者EBV株化Bリンパ球で確認するとともに、患者の好中球、繊維芽細胞、Bリンパ球、赤血球、血小板などに正常 -アクチンの他に、異常 -アクチンの他に、異常 -アクチンが発現していることを明らかにし、異常 -アクチンが発現していることを明らかにし、異常 -アクチンのcDNAの塩基配列を決定した。このcDNAは1131番目のグアニンがアデニンに一塩基置換していた。この結果、 -アクチンのcDNAの塩基配列を決定した。このcDNAは1131番目のグアニンがアデニンに一塩基置換していた。この結果、 -アクチンでは、364番目のアミノ酸がグルタミン酸からリジンに置換していることが明らかになった。さらに、患者ゲノムDNAを解析し、一方のアレルに変異のあることを明らかにした。今回のように、自然に生じた変異 -アクチンでは、364番目のアミノ酸がグルタミン酸からリジンに置換していることが明らかになった。さらに、患者ゲノムDNAを解析し、一方のアレルに変異のあることを明らかにした。今回のように、自然に生じた変異 -アクチンの発見は、ヒトを含むほ乳類ではじめてである。新しい好中球機能異常を伴う疾患と考えられる。 -アクチンの発見は、ヒトを含むほ乳類ではじめてである。新しい好中球機能異常を伴う疾患と考えられる。 まず、患者好中球の機能解析をした。ボイデン-チャンバー法による遊走能は、fMLP,ザイモザン刺激いずれの場合も対照の1/3程度であり、Candidaに対する貪食能も低下していた。また、fMLP、コンカナバリンA刺激において、スーパーオキシド産生能が患者好中球では対照の1/5と低下していた。さらに、fMLP刺激時の脱分極・再分極反応は対照と比較して明らかな低下が見られた。そこで、患者好中球及び対照となる細胞中のタンパク質を2次元電気泳動(2D-PAGE)で解析した。その結果、患者好中球にだけ、 -, -,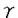 -アクチンと同分子量(42KDa)で、等電点が塩基性側にシフトした特異的な異常スポットを見いだした。そのようなスポットは、正常対照好中球や白血病患者の末梢血好中球には認められなかった。一方、同様の特異的スポットは、患者の血小板、赤血球、繊維芽細胞、EBV株化B細胞など調べた患者の細胞すべてに認められた。 -アクチンと同分子量(42KDa)で、等電点が塩基性側にシフトした特異的な異常スポットを見いだした。そのようなスポットは、正常対照好中球や白血病患者の末梢血好中球には認められなかった。一方、同様の特異的スポットは、患者の血小板、赤血球、繊維芽細胞、EBV株化B細胞など調べた患者の細胞すべてに認められた。 EBVで株化した患者由来のB細胞のタンパク質を2D-PAGE後、異常スポットを切り出し、凍結乾燥後、タンパク質を125Iで標識した。標識したタンパク質はキモトリプシンで部分分解し、そのペプチドマッピングパターンを対照と比較した。患者特異的スポットのパターンは、対照 -、 -、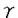 -アクチンのパターンと一致した。更に、抗アクチン単クローン抗体でイムノブロットしたところ、抗体は -アクチンのパターンと一致した。更に、抗アクチン単クローン抗体でイムノブロットしたところ、抗体は -, -,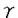 -アクチンの他に患者特異的スポットと反応した。これらのことから、患者細胞には正常 -アクチンの他に患者特異的スポットと反応した。これらのことから、患者細胞には正常 -, -,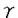 -アクチンの他に、変異アクチンが存在すると結論した。 -アクチンの他に、変異アクチンが存在すると結論した。 キャッピング法を用いて完全長cDNA libraryを患者由来EBV株化B細胞から作成した。ヒト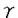 -アクチンcDNAをプローブとして、コロニーハイブリダイゼイション法により、全アミノ酸をコードしている完全長cDNAを -アクチンcDNAをプローブとして、コロニーハイブリダイゼイション法により、全アミノ酸をコードしている完全長cDNAを -アクチン、 -アクチン、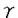 -アクチンそれぞれ8クローンづつを得た。それらcDNAのin vitroトランスレーション産物を2D-PAGEで解析したところ、 -アクチンそれぞれ8クローンづつを得た。それらcDNAのin vitroトランスレーション産物を2D-PAGEで解析したところ、 -アクチン3クローンにおいて、コントロールと比較して分子量は同じだが、等電点が塩基性に変化し、患者試料で見られたのと同様のスポットを検出した。これらクローンの塩基配列を決定したところ、1131番目のグアニンがアデニンに置換しており、変異 -アクチン3クローンにおいて、コントロールと比較して分子量は同じだが、等電点が塩基性に変化し、患者試料で見られたのと同様のスポットを検出した。これらクローンの塩基配列を決定したところ、1131番目のグアニンがアデニンに置換しており、変異 -アクチンは、364番のグルタミン酸がリジンに変化したものと結論した。次に、患者ゲノムの変異部位を挟む領域をPCRにより増幅し、405bpの産物を得た。正常配列は制限酵素HinfIにより切断されるが、変異配列は切断されない。PCR産物を分離、精製後、HinfI処理したところ、405bp,340bp,65bpの3本のバンドが見られた。405bpのバンドは切断されなかった変異配列と考えられる。これに対して、対照では、HinfIで切断された340bp,65bpのバンドのみが見られた。また、PCR産物をサブクローニングし、塩基配列を決定したところ、約半数のクローンにcDNAと同じ変異が認められた。従って、患者は片方のアレルの異常であることが明らかになった。 -アクチンは、364番のグルタミン酸がリジンに変化したものと結論した。次に、患者ゲノムの変異部位を挟む領域をPCRにより増幅し、405bpの産物を得た。正常配列は制限酵素HinfIにより切断されるが、変異配列は切断されない。PCR産物を分離、精製後、HinfI処理したところ、405bp,340bp,65bpの3本のバンドが見られた。405bpのバンドは切断されなかった変異配列と考えられる。これに対して、対照では、HinfIで切断された340bp,65bpのバンドのみが見られた。また、PCR産物をサブクローニングし、塩基配列を決定したところ、約半数のクローンにcDNAと同じ変異が認められた。従って、患者は片方のアレルの異常であることが明らかになった。 患者細胞から細胞質画分を調製し、キャリアーとなる対照アクチン、高濃度Mg2+,K+を添加してアクチンを重合させた。重合したアクチンを遠心分離により回収し、その一部を2D-PAGEで解析し、残りは重合・脱重合を計3回繰り返した。正常アクチンと変異アクチンの量比は重合・脱重合を繰り返しても、変化せず、変異アクチンが正常アクチンと同様の重合能を保持していることを示した。 変異 -アクチンの立体構造の変化をquantaプログラムにより予測したところ、ポリペプチドの炭素骨格主鎖は変異部位以外は全く野性型と同じ位置にきた。タンパク質表面電荷の分布を計算したところ、変異部位の周囲でマイナス電荷からプラス電荷へ大きく変化していた。 -アクチンの立体構造の変化をquantaプログラムにより予測したところ、ポリペプチドの炭素骨格主鎖は変異部位以外は全く野性型と同じ位置にきた。タンパク質表面電荷の分布を計算したところ、変異部位の周囲でマイナス電荷からプラス電荷へ大きく変化していた。 細胞の機能に変化を与えるアクチン部位の研究は、遺伝子工学技術の利用、もしくは化学発癌剤により引き起こされたアクチンの変異を用いて、培養細胞を材料として進められてきた。一方、Drorosophillaの飛翔筋にだけ発現しているアクチンAct88Fの変異型を、Act88F欠損株に発現させ、その効果を調べた実験が、唯一、変異アクチンが個体レベル(筋肉組織)に与える影響を調べたものである。 私は今回、好中球に機能異常を認めた患者細胞を調べ、好中球をはじめ、その他調べたすべての細胞に、正常 -アクチンの他に変異 -アクチンの他に変異 -アクチンが発現していることを見いだした。知る限り、今回のように自然に生じた変異 -アクチンが発現していることを見いだした。知る限り、今回のように自然に生じた変異 -アクチンの発見は、ヒトを含むほ乳類ではじめてである。この変異 -アクチンの発見は、ヒトを含むほ乳類ではじめてである。この変異 -アクチンcDNAは、翻訳領域の1131番目のグアニンがアデニンヘ置換していた。この変異は患者ゲノムDNAでも確認された。 -アクチンcDNAは、翻訳領域の1131番目のグアニンがアデニンヘ置換していた。この変異は患者ゲノムDNAでも確認された。 -actinの364番目のアミノ酸は、重合に関与する部位ではないことが、X線結晶解析の結果から示されている。実際、変異 -actinの364番目のアミノ酸は、重合に関与する部位ではないことが、X線結晶解析の結果から示されている。実際、変異 -アクチンは正常アクチンと同等の重合能を保持していた。 -アクチンは正常アクチンと同等の重合能を保持していた。 アクチンにおいて、364番のグルタミン酸とその近傍(355-375残基)は、いくつかのタンパク質と相互作用する領域として知られている。特に、アカントアメーバのプロフィリンの115番のリジンが、アクチンの364番目(今回の変異部位)のグルタミン酸と相互作用していることが示されていることから、変異 -アクチンとプロフィリンとの相互作用では重大な変化があると推定され、実際、グルタチオンS-トランスフェラーゼとプロフィリンIの融合タンパク質との変異 -アクチンとプロフィリンとの相互作用では重大な変化があると推定され、実際、グルタチオンS-トランスフェラーゼとプロフィリンIの融合タンパク質との変異 -アクチンの結合能は、野性型の1/2から1/4に低下していることが明らかになった。 -アクチンの結合能は、野性型の1/2から1/4に低下していることが明らかになった。 また、患者の細胞には、正常 -アクチンもほぼ等量発現しており、患者ゲノムDNAの解析から一方のアレルの異常であることが判明した。患者は、好中球の異常に起因すると考えられる易感染性、日光過敏、精神発達遅延などの症状を示していることから、種々の細胞で、変異 -アクチンもほぼ等量発現しており、患者ゲノムDNAの解析から一方のアレルの異常であることが判明した。患者は、好中球の異常に起因すると考えられる易感染性、日光過敏、精神発達遅延などの症状を示していることから、種々の細胞で、変異 -アクチン(E364K)が正常 -アクチン(E364K)が正常 -アクチンに対してドミナントネガティブに働くと考えられた。また、 -アクチンに対してドミナントネガティブに働くと考えられた。また、 -アクチンの変異により、好中球のスーパーオキシド産生が影響を受けたことは、スーパーオキシド産生機構とアクチンの関わりを示し、特に興味深い。 -アクチンの変異により、好中球のスーパーオキシド産生が影響を受けたことは、スーパーオキシド産生機構とアクチンの関わりを示し、特に興味深い。 患者の臨床症状は、好中球機能異常を伴う易感染性のみならず、日光過敏症、精神発達遅延と多岐に渡り、これらの症状と -アクチンの変異がどのような関連にあるかを今後明らかにする必要がある。 -アクチンの変異がどのような関連にあるかを今後明らかにする必要がある。 |