ヒト免疫不全ウイルス1型(human immunode ficiency virus type1:HIV-1)のエンベロープタンパクEnvは、前駆体gp160がゴルジ装置でプロテアーゼによりgp120とgp41に開裂されて生物活性を得る。gp120には30近いアスパラギン結合型糖鎖付加配列が認められ、すべての部位に実際に糖鎖が付加されている。これらの糖鎖は、HIV-1の抗原エピトープを覆い隠すとともに、HIV-1の感染性や細胞傷害性にも影響すると考えられているが、個々の糖鎖のHIV-1の生活環における実際の役割は明らかではない。 HIV-1は株によって感染性、細胞宿主域、細胞傷害性が大きく異なり、感染初期の感染者から得られるウイルスは、株化T細胞では増殖せず末梢血単核細胞(peripheral blood mononuclear cells:PBMC)やマクロファージで増殖し、マクロファージ指向性ウイルスと呼ばれる。一方、感染後期に得られる株は株化T細胞でも増殖することから株化T細胞指向性ウイルスと呼ばれる。近年、HIV-1の細胞への結合に必要なレセプターCD4に加えて、ケモカインレセプターが膜融合に必要なコレセプターとして同定され、HIV-1の細胞指向性の違いは、HIV-1が膜融合の際に使用するケモカインレセプターの違いに起因することが明らかになった。すなわち株化T細胞指向性ウイルスはCXCR-4、マクロファージ指向性ウイルスはCCR-5を膜融合の際コレセプターとして使用する。 HIV-1のgp120の3番目の高度可変領域V3は35アミノ酸からなり、HIV-1の細胞宿主域を決定する重要な領域として知られている。1番目のシステインから数えて11番目または25番目の位置に塩基性アミノ酸が存在すると株化T細胞に感染できるようになる。このV3ループ内にはアスパラギン結合型糖鎖付加部位が1箇所存在し、末端にシアル酸をもつ複合型糖鎖が付加されている。この糖鎖付加部位は全てのHIV-1の90%以上の株で、日本や欧米で主要な流行株であるサブタイプBに限れば97%の株で保存されているにもかかわらず、あまり重要視されてこなかった。 本研究ではV3内アスパラギン結合型糖鎖の意義を検討するために、まず株化T細胞指向性HIV-1NL43株のV3ループ内糖鎖付加信号Asn-Asn-Thr(NNT)を、部位特異的変異導入によりHis-Asn-Thr(HNT)に変換した変異ウイルス、NL43HNTを作成した。Leeらの報告によれば、やはり株化T細胞指向性のHXB2株では、V3内の糖鎖を欠失させても、ウイルスの感染性や細胞指向性に何の影響も認められないとされてきた(Lee et al.,1992)。しかしNL43株を用いた我々の実験結果では糖鎖変異ウイルスNL43HNTの増殖は親株NL43に比べて明らかに低下し、糖鎖がHIV-1の感染性に関与していることが推測された。しかし大量のHIV-1を感染に用いると、その増殖の差ははっきりとは認められず、Leeらの結果の違いは感染実験に用いたウイルス量の違いにあると考えられた。 HIV-1のCD4陽性細胞への結合にV3内糖鎖の欠失が影響するか否かを検討するために、NL43HNTと親株NL43のgp120のCD4結合能を比較した。センダイウイルスベクターを用いてこれらのgp120を大量に発現させ、MT4細胞と反応させたのちに、抗gp120モノクローナル抗体(902)を用いてgp120の細胞への結合を比較した。その結果、親株gp120もNL43HNTgp120も同様に細胞に結合した。また、gp120による抗CD4抗体(Leu3a)の結合阻害を検討したが、これも親株と変異体で大きな差は見られなかった。以上の結果から、V3内糖鎖の有無はgp120のCD4への結合能には影響しないことが明らかになった。 次に糖鎖変異ウイルスの細胞への吸着、侵入、DNA合成の各ステップを感染性HIV-1そのものを用いて検討したところ、親株と比較して侵入効率の低下が認められた。また糖鎖の欠失がEnvタンパクの発現そのものや、前駆体gp160のgp120とgp41への開裂に影響するか否かを、ワクシニアウイルスベクターを用いてNL43HNTと親株NL43のEnv蛋白を発現させて検討したが、変異体のEnv蛋白gp160も親株と同様に発現され開裂されることが確認された。さらに、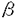 -ガラクトシダーゼをレポーター遺伝子として用いる細胞融合実験をおこなったところ、NL43HNTではCXCR-4依存性細胞融合能が親株の1/3に低下していることがわかり、NL43HNTの感染性低下は膜融合能の低下に基づく侵入効率の低下によるものと考えられた(図)。 -ガラクトシダーゼをレポーター遺伝子として用いる細胞融合実験をおこなったところ、NL43HNTではCXCR-4依存性細胞融合能が親株の1/3に低下していることがわかり、NL43HNTの感染性低下は膜融合能の低下に基づく侵入効率の低下によるものと考えられた(図)。 NL43HNTの膜融合能の低下が、糖鎖を除去したことによるのか、あるいは糖鎖は関係なくアスパラギンからヒスチジンヘアミノ酸が変化したことによるのかを明らかにするために、NL43の糖鎖付加シグナルNNTをAsn-Asn-Ile(NNI)に変換した第2の変異体を作成したが、やはりCXCR-4依存性の細胞融合能はNL43HNTと同様に低下しており(図)、アミノ酸置換よりも糖鎖の欠失が細胞融合能を低下させたものと考えられる。 また、NL43のV3に対する中和抗体、902抗体による中和試験を行ったところ、NL43HNTは親株に比べて中和抗体に対する感受性が上昇していた。この結果はBackらの報告と一致しており(Back et al.,1994)、この糖鎖がHIV-1の抗原エピトープを覆い隠す役割を実際に果たしていると考えられる。 前述のとおりV3内糖鎖はほとんど全てのHIV-1に認められるが、例外的にV3領域内の糖鎖付加シグナルを持たないHIV-1が報告されている。それらのV3ループのアミノ酸配列を詳細に検討した結果、糖鎖付加シグナルを持たないHIV-1は、V3ループの11番目のアミノ酸が塩基性のリジンやアルギニンに変化しているものばかりであることが明らかになった。そこでNL43HNTの11番目のアミノ酸を塩基性アミノ酸であるアルギニンに変換したHIV-1NL43HNTRを作成したところ、増殖力の回復が認められた。この結果から、11番目のアミノ酸が塩基性アミノ酸へと変化することが、糖鎖の欠如を補い得るものと考えられる。 HIV-1は株間で細胞指向性や細胞傷害性が大きく異なる。そこでマクロファージ指向性のSF162、マクロファージにも株化T細胞にも感染できるSF13の2株についても、V3ループ内の糖鎖付加シグナルNNTをNNIに変換した変異ウイルスを作成した。SF13NNIの増殖が特に株化T細胞で顕著に低下したが、SF162NNIでは増殖の低下は認められなかった。また、SF13NNIもマクロファージにおいては、親株SF13と同程度に増殖した。ワクシニアウイルスベクターにてSF162、SF13株と各糖鎖変異ウイルスのEnvを発現し、NL43株と同様に細胞融合実験を行い、コレセプター依存性細胞融合能を比較したところ、糖鎖変異ウイルスのEnvによる細胞融合の低下が主にCXCR-4依存性細胞融合において認められ、CCR-5依存性細胞融合ではSF162でもSF13でも親株と変異株でそれほどの差は見られなかった(図)。この結果は変異ウイルスの株化T細胞への感染性の低下とよく一致するものであった。またSF13NNIはSF13よりCXCR-4依存性細胞融合能の低下に伴い、CCR-5依存性が強くなっていると予想されるが、CCR-5のリガンドであるMIP-〓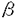 は予想どおりSF13の増殖を阻害せず、SF13NNIの増殖を阻害した。以上の結果からNL43とは細胞指向性の異なるSF13やSF162でもV3内糖鎖はCCR-5依存性細胞融合には影響せず、CXCR-4依存性細胞融合に必要であることが明らかになった。 は予想どおりSF13の増殖を阻害せず、SF13NNIの増殖を阻害した。以上の結果からNL43とは細胞指向性の異なるSF13やSF162でもV3内糖鎖はCCR-5依存性細胞融合には影響せず、CXCR-4依存性細胞融合に必要であることが明らかになった。 以上の結果から、V3領域内の糖鎖は抗原エピトープを覆い隠すためだけでなく、HIV-1がCXCR-4依存的に効率よく標的細胞に侵入するためにも必要であると考えられた。また、株化T細胞指向性HIV-1の糖鎖を含めたV3領域がCXCR-4と相互作用する可能性が示された。しかし11番目のアミノ酸をアルギニンに変換することで糖鎖除去による感染性の低下が回復することから、糖鎖自身がCXCR-4と相互作用する可能性は低いと考えられる。塩基性アミノ酸の増加または糖鎖の存在がgp120の親水性を上昇させ、V3ループをより露出してCXCR-4との相互作用を容易にするのかもしれない。糖鎖の分子量は2000-3000と推測され、V3の分子構造に対する糖鎖の影響は無視できないほど大きい。 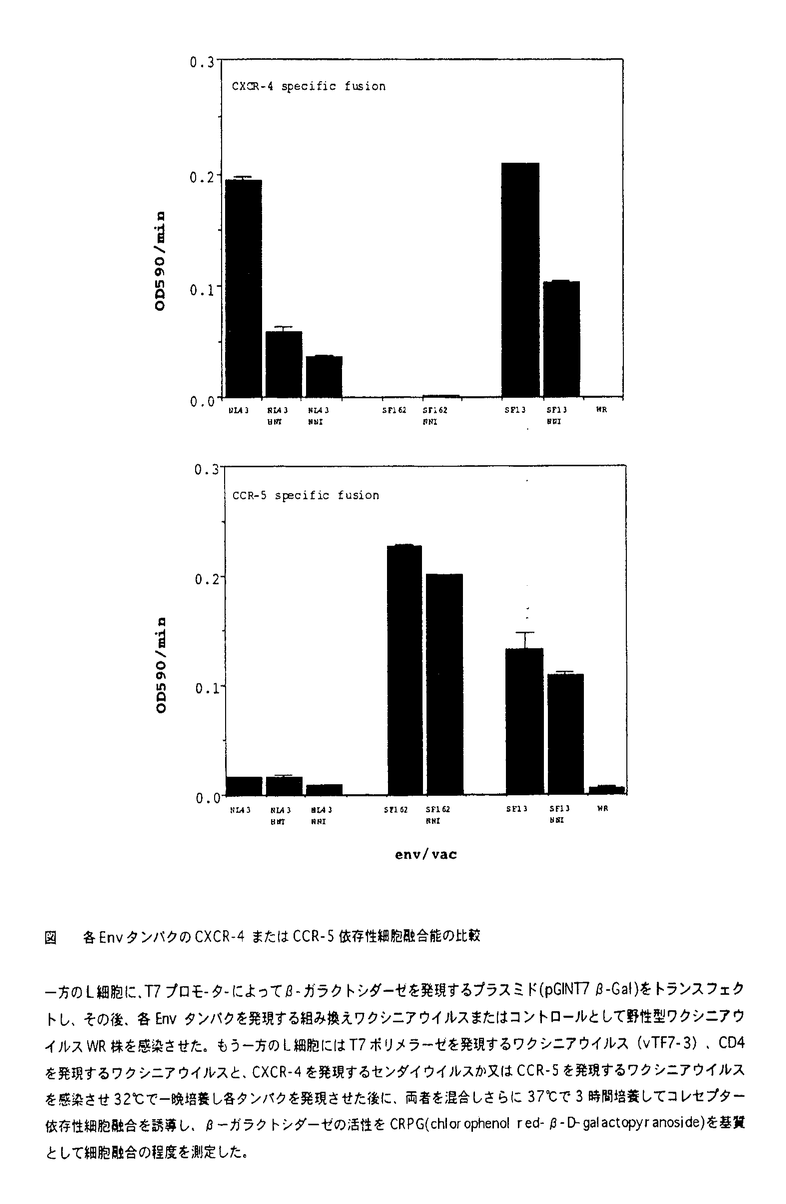 図 各EnvタンパクのCXCR-4またはCCR-5依存性細胞融合能の比較一方のL細胞に、T7プロモーターによって 図 各EnvタンパクのCXCR-4またはCCR-5依存性細胞融合能の比較一方のL細胞に、T7プロモーターによって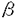 -ガラクトシダーゼを発現するプラスミド(pGINT7 -ガラクトシダーゼを発現するプラスミド(pGINT7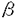 -Gal)をトランスフェクトし、その後、各Envタンパクを発現する組み換えワクシニアウイルスまたはコントロールとして野性型ワクシニアウイルスWR株を感染させた。もう一方のL細胞にはT7ポリメラーゼを発現するワクシニアウイルス(vTF7-3)、CD4を発現するワクシニアウイルスと、CXCR-4を発現するセンダイウイルスか又はCCR-5を発現するワクシニアウイルスを感染させ32℃で一晩培養し各タンパクを発現させた後に、両者を混合しさらに37℃で3時間培養してコレセプター依存性細胞融合を誘導し、 -Gal)をトランスフェクトし、その後、各Envタンパクを発現する組み換えワクシニアウイルスまたはコントロールとして野性型ワクシニアウイルスWR株を感染させた。もう一方のL細胞にはT7ポリメラーゼを発現するワクシニアウイルス(vTF7-3)、CD4を発現するワクシニアウイルスと、CXCR-4を発現するセンダイウイルスか又はCCR-5を発現するワクシニアウイルスを感染させ32℃で一晩培養し各タンパクを発現させた後に、両者を混合しさらに37℃で3時間培養してコレセプター依存性細胞融合を誘導し、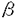 -ガラクトシダーゼの活性をCRPG(chlor ophenol red- -ガラクトシダーゼの活性をCRPG(chlor ophenol red-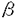 -D-galactopyranoside)を基質として細胞融合の程度を測定した。 -D-galactopyranoside)を基質として細胞融合の程度を測定した。 |