Human immunodeficiency virus type1 (HIV-1)をはじめとするレンチウイルスのエンベロープ蛋白質は多くのアスパラギン結合型の糖鎖を持つ。HIV-1SF2株の場合、gp120部分に26ケ所、gp41部分に4ケ所の糖鎖付加部位が存在し、実際に糖鎖が付加されている。そのうち、約半数は複合型の糖鎖である。複合型の糖鎖の末端には最低2個のシアル酸が結合している。シアル酸は糖鎖成分の中でマイナスの電荷を持つため、gp120に10本以上存在する複合型糖鎖の末端のシアル酸はgp120に大量のマイナスの電荷を付与していることが予想される。 事実、gp120のアミノ酸の配列から予想される等電点は8.5強であるが、実際に等電点電気泳動を行うと、gp120は中性から酸性側に泳動されることが報告されている。そして、そのgp120の糖鎖末端シアル酸を除去すると、アミノ酸配列から予想される等電点に近い、7.5以上という数字が得られる。本研究は、このようgp120に大量のマイナスの電荷を付与している糖鎖末端シアル酸の意義を明らかにする目的で、HIV-1あるいは細胞をneuraminidase(NA)処理して、HIV-1増殖に及ぼす影響を検討した。 まず、リンパ球系のMT4細胞にHIV-1SF2株を感染させ、培地に1.0U、0.5U、0.03U、あるいは0.003U/mlのNAを添加し、培養上清中の逆転写酵素RTの活性を経時的に測定した。図に示すように添加したNAの量依存的に、ウイルスの増殖が感染後11日目では100倍以上も促進されることが明らかなった。NAの効果はHIV-1単一の増殖周期(一段増殖)では6-10倍の促進効果があり(後述のウイルスベクターの結果より)、多段増殖を重ねると増幅されて大きな差になってくると考えられる。図の右側には感染後、3日目の感染細胞の形態を示すが、通常、巨細胞形成を示さないMT4細胞が、NAの添加により、顕著な多核巨細胞を形成した。また、NAによるHIV-1の増殖促進効果は、NAの阻害剤である2-deoxy-2,3-dehydro-N-acetylneuraminic acid(DANA)により完全に打ち消された。 NA処理したウイルスには補体系を活性化させる効果があることが知られている。またHIV-1が補体を仲立ちにして補体レセプターに結合することにより、細胞への吸着が促進されることも知られている。我々は、56℃、30分間非働化した牛胎児血清を培養に使用しているが、念のため補体の関与の可能性を検討した。まったく非働化していない血清を含む培地、56℃で1時間非働化した血清を含む培地、および無血清合成培地でHIV-1感染MT4細胞を培養し、培地にNAを添加した。感染後3日目の培養上清中のp24量を測定したところ、いずれの場合でもほぼ同様の増殖促進効果が認められた。以上の結果から、ここで見られたNAによるHIV-1の増殖促進効果に補体は関与しないことが確認された。 NAは広く細菌やウイルスなどの病原体に認められる。これらの病原体がHIV感染者に感染し、HIV-1の体内増殖に影響する可能性が考えられる。そこで、Arthrobacter,Streptococus,Vibrio Cholerae,Salmonellaなどの細菌由来のNAを感染細胞の培地に加えて増殖促進が認められるか否かを検討した。またNAを発現するセンダイウイルスをMT4細胞に共感染させてHIV-1増殖に及ぼす影響を検討した。いずれの場合でもほぼ同様なHIV-1増殖促進効果が認められた。感染者体内で日和見感染したNA産生性の病原体がHIV-1の増殖を実際に増強しているか否かは、今後の課題である。 さてHIV-1粒子表面と同様に、細胞表面にもシアル酸は存在する。従って、細胞側とHIV-1側のどちらのシアル酸がNAによるHIV-1増殖の促進に関係しているかを、明らかにする必要がある。このため、MT4あるいはHIV-1をそれぞれ単独でNA処理してから感染させ、NAを含まない培地で洗浄後培養し、感染後3日目の培養上清のウイルス量を測定した。HIV-1のみを処理した場合とMT4とHIV-1の両者をNA処理した場合に強い増殖の促進が認められ、MT4だけを処理した場合には強い促進は認められなかった。このことは、細胞側でなく、HIV-1粒子側のシアル酸の除去がHIV-1増殖の促進をもたらしていたことを示している。また、事前にMT4を抗CD4抗体Leu3Aで処理するとNAによる促進効果はほとんど認められなくなたことから、NAにより促進したHIV-1の感染も、CD4をレセプターとして用いていると考えられる。 次に、HIV-1の生活環のどの部分がNAによって促進されるのかを検討した。HIV-1をMT4に4℃で1時間吸着させた後、細胞を4回洗浄してから可溶化して、MT4に吸着したP24量を測定した。また、洗浄後37℃でさらに1時間培養した上でトリプシン処理をおこなってから可溶化して、細胞内に侵入したP24量を測定した。さらに感染後24時間培養してから、プロウイルスの合成を定量的PCR法で定量した。いずれの実験でも事前にHIV-1をNA処理した場合に大きな増大が認められた。これらのことから、NA処理はHIVの細胞への吸着効率を上昇させる効果があることがわかった。NAによるHIV-1の細胞への吸着効率の上昇はウイルス粒子表面のchargeの除去によるものと考えられるが、シアル酸分子自身はgp120とgp41または細胞表面受容体との結合の安定性を弱めている可能性も否定できない。 NA処理によりgp120の糖鎖末端からシアル酸が本当に除去された否かをシアル酸除去後に糖鎖末端に露出するGal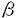 -1-4 GlcNAc構造を認識するレクチンRCA-1を用いて検討した。無血清培地で培養したHIV-1ウイルスをNA処理してから、濃縮して、可溶化し、gp120をSDS-PAGEで分離し、ナイロン膜に移行させ、RCA-1と反応させた。NA処理したgp120はSDS-PAGEでの移動度が少し早くなり、RCA-1で強く認識されるようになった。従って、NA処理によりgp120の糖鎖末端のシアル酸が除去されたことが確認された。また、シアル酸除去したgp120はgalactose残基が露出し、この露出したgalactoseが細胞表面のgalactose受容体と反応してHIV-1の増殖に影響する可能性がある。そのため、galactose受容体に競合的に結合するD-galactose或いはN-acetyl-DgalactosamineをNAと同時に感染細胞の培地に加えて、HIV増殖に及ぼす影響を検討したが、いずれもNAのHIV-1増殖促進効果に影饗を与えなかった。従ってNAのHIV-1増殖促進効果はgalactose-galactose受容体の相互作用によるものではないことが明らかになった。 -1-4 GlcNAc構造を認識するレクチンRCA-1を用いて検討した。無血清培地で培養したHIV-1ウイルスをNA処理してから、濃縮して、可溶化し、gp120をSDS-PAGEで分離し、ナイロン膜に移行させ、RCA-1と反応させた。NA処理したgp120はSDS-PAGEでの移動度が少し早くなり、RCA-1で強く認識されるようになった。従って、NA処理によりgp120の糖鎖末端のシアル酸が除去されたことが確認された。また、シアル酸除去したgp120はgalactose残基が露出し、この露出したgalactoseが細胞表面のgalactose受容体と反応してHIV-1の増殖に影響する可能性がある。そのため、galactose受容体に競合的に結合するD-galactose或いはN-acetyl-DgalactosamineをNAと同時に感染細胞の培地に加えて、HIV増殖に及ぼす影響を検討したが、いずれもNAのHIV-1増殖促進効果に影饗を与えなかった。従ってNAのHIV-1増殖促進効果はgalactose-galactose受容体の相互作用によるものではないことが明らかになった。 シアル酸は糖鎖のプロセシングの最後の過程で複合型糖鎖の末端に付与される。この反応のためにはゴルジ体の中でMannosidase I,IIなどの酵素により高マンノース型糖鎖のmannose残基がいくつかが切り取られる必要がある。Mannosidase IとIIの阻害剤である1-deoxymannojirimycin(DMM)とswainsonine(SW)は、これらの反応を停止させ、すべての糖鎖を高マンノース型糖鎖に保つことが知られている。従ってこれらの阻害剤で処理した細胞から生産されたHIV-1の糖鎖末端にはシアル酸は存在しないはずである。そこで、これらの阻害剤を培地に加えてHIV-1増殖に及ぼす影響を検討した。予想どおりDMMとSWにはNAと同様なHIV-1増殖促進効果が認められた。 最後にHIV-1SF2株とは細胞宿主域の異なるHIV-1SF162株や臨床分離株、さらに他の霊長類レンチウイルスであるHIV-2GH123株とSIVMAC239株の増殖もNAが増強するか否かを検討したところ、いずれのウイルスもNAによってその増殖が促進された。従ってNAによる増殖促進はアスパラギン結合型糖鎖の多いレンチウイルス一般に認められる現象と考えられる。さらに、一段増殖のみを行うHIVベクターの形質転換効率も約6倍上昇した。 以上の結果からウイルス粒子表面のシアル酸はHIV-1の感染能を負に制御していることを示された。一方、HIV-1に大量に認められる糖鎖は、一般に抗原エピトープを覆い隠して、HIV-1の免疫機構からの逃避にも寄与していると考えられている。従って、HIV-1の糖鎖には感染能の制御と免疫機構からの逃避との二つの役割がある。レンチウイルスは一般に緩慢で持続的な感染様式を示し、このような感染様式の一要因として糖鎖末端シアル酸による感染能の抑制があるかもしれない。 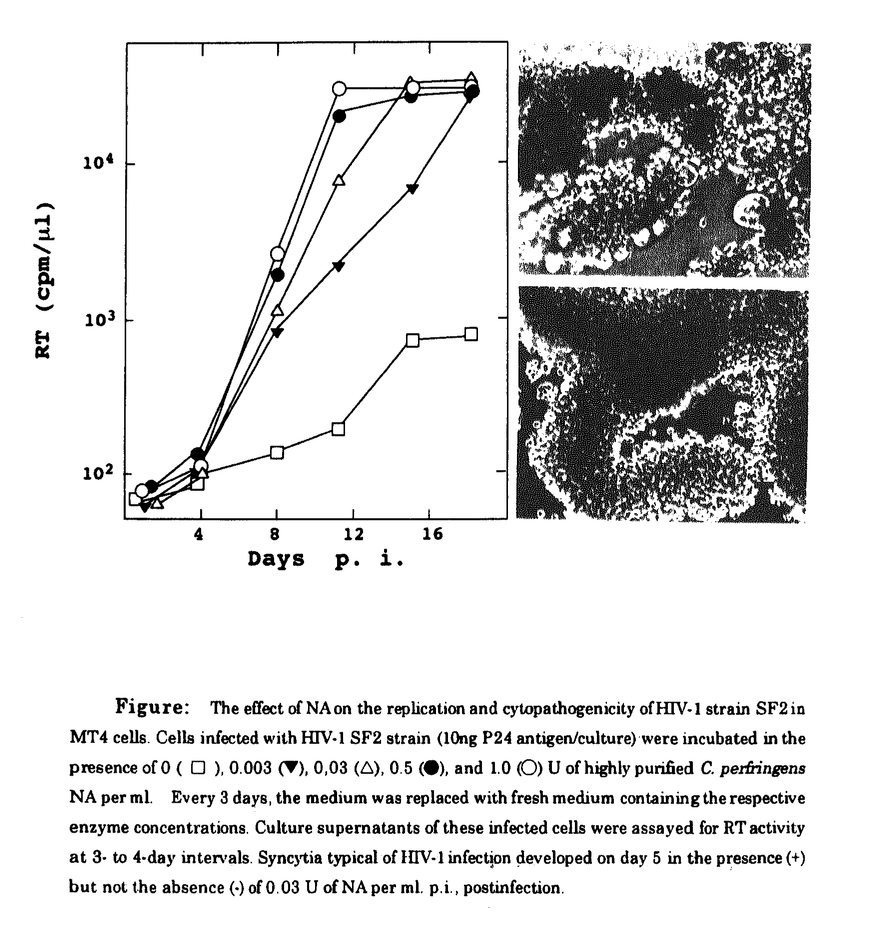 Figure:The effect of NA on the replication and cytopathogenicity ofHIV-1 strain SF2 in MT4 cells.Cells infected with HIV-1 SF2 strain(10ng P24 antigen/culture)were incubated in the presence of 0(□),0.003(▼),0,03(△),0.5(●),and1 .0(○)U of highly purified C.perfringens NA per ml.Every 3 days,the medlum was replaced with fresh medium containing the respective enzyme concentrations. Culture supernatants of these infected cells were assayed for RT activity at 3-to 4-day intervals.Syncytia typical of HIV-1 infection developed on day 5 in the presence(+)but not the absence(-)of 0.03 U of NA per ml.p.i.,postinfection. Figure:The effect of NA on the replication and cytopathogenicity ofHIV-1 strain SF2 in MT4 cells.Cells infected with HIV-1 SF2 strain(10ng P24 antigen/culture)were incubated in the presence of 0(□),0.003(▼),0,03(△),0.5(●),and1 .0(○)U of highly purified C.perfringens NA per ml.Every 3 days,the medlum was replaced with fresh medium containing the respective enzyme concentrations. Culture supernatants of these infected cells were assayed for RT activity at 3-to 4-day intervals.Syncytia typical of HIV-1 infection developed on day 5 in the presence(+)but not the absence(-)of 0.03 U of NA per ml.p.i.,postinfection. |