a.研究目的 急性期脳虚血病変では、梗塞に陥った組織の容積及び部位、側副血行路の状態、年齢などに差異が存在し、神経細胞の障害の程度を非侵襲的あるいは低侵襲的に表す方法は現在のところ数少ない。脳虚血病変の診断において重要なのは、回復可能なischemic penumbraと回復不可能な梗塞領域とを区別し、血栓溶解剤動注療法に代表される介入療法の適応となるのか、保存的に加療するのかを決定することである。現在臨床的には発症からの経過時間で治療法が決定されることが多いが、臨床例では上記の差異が存在するため、厳密には適切ではない。
梗塞の不可逆性を判定する手法としてPositron emission tomographyや磁気共鳴画像magnetic resonance imaging(以下MRI)を用いた潅流画像が存在するが、信号雑音比や時間分解能の点で問題が残る。
拡散強調画像diffusion weighted imaging(以下DWI)は、臨床的に超急性期脳梗塞の描出に非常に有効であるが、現段階では梗塞部は高信号として描出できるが、penumbraを画像化することはできないとされる。この理由として、DWIが画像化している情報が、生体内に普遍的に、すなわち細胞内外両腔に存在している自由水から得られていることが考えられる。細胞内外の自由水ADCを別々に求める方法が現段階では無いため、脳虚血時に自由水DWIで観測される変化に対して、それぞれのADCがどれだけ寄与しているかを判定することができず、局所の細胞の性質を正確に把握することができない。さらに本来物質のADCはテンソルtensorで表されるべきものであるが、現在臨床で用いられている自由水DWIはテンソルの当該一軸への投影画像であることが多く、各施設間、各装置間、各症例毎のADCを絶対値として比較することを困難にしている。
細胞骨格や機能に関する、より特異的な情報を得るための手法に磁気共鳴スペクトロスコピーmagnetic resonance spectroscopy(以下MRS)がある。プロトンMRSで観測される代謝物質であるN-アセチルアスパラギン酸N-acetylaspartate(以下NAA)、コリン含有化合物choline containing compounds(以下Cho)及びクレアチン及びクレアチンリン酸creatine and phosphocreatine(以下Cre)は主に細胞内に存在しており、これらのADCを検討することにより、自由水DWIでは達成し得ない、細胞内環境に特異的な拡散の変化を得ることが可能となる。
本研究では、7tesla(以下T)のMR装置を用いて、stimulated echo acquisition mode(以下STEAM)法により、発症9時間後まで梗塞半球及び非梗塞半球のNAA、Cho、Cre、グルタミンglutamine(Gln)/グルタミン酸glutamate(Glu)complex(両者を合わせて以下Glx)のADCを検討する。代謝物質のADCが虚血の進行と相関して低下するならば、これら代謝物質ADCの低下度と細胞障害の程度を関連付けることができ、さらには細胞内環境のみを特異的に表す代謝物質ADCより、梗塞部とpenumbraを区別することが可能になることが期待される。また急性期脳梗塞における自由水ADC低下の機序の解明の手がかりになると考えられる。
これらの検討により以下の3点を明らかにする。
1)超急性期の梗塞半球における代謝物質ADCの経時的変動。
2)超急性期の非梗塞半球におけるtranshemispheric diaschisisの評価。
3)梗塞半球における細胞障害及び非梗塞半球におけるtranshemispheric diaschisisのマーカーとしてどの代謝物質が優れているか。
ラット半球梗塞における代謝物質のADCに関する論文は、調べ得た範囲で、1つであり、4.7Tの装置を用いて発症3時間後における梗塞半球のCre及びNAAのADCの低下と、24時間後における非梗塞半球のCre及びNAAのADCの低下が報告されている。後者は半球梗塞の結果生じる半球間のdiaschisisの一種と思われるが、脳梗塞急性期におけるtranshemispheric diaschisisは未だ評価されていない。
したがって、より信号雑音比に優れた7Tという超高磁場MR装置を用いた点、脳梗塞急性期における梗塞半球及び非梗塞半球のADCをより高い時間分解能で測定した点、さらにGlxに関するADCを測定した点に本論文の独創性がある。
d.考察 虚血後1時間における梗塞半球の代謝物質の拡散は、非梗塞半球2時間時のそれに比べて、それぞれCho 25%、Cre 16%、Glx 14%、NAA 19%有意に低下した。Glx以外の代謝物質のADC変化は自由水のそれと比べていずれも大きいのは、penumbra領域だけでなく、梗塞半球における非梗塞部にも代謝物質のADC低下が起こっている(intrahemispheric diaschisis)可能性や、脳梗塞時おける代謝物質のADC低下が自由水よりも大きい、すなわち鋭敏である可能性が考えられる。
本研究において最初に報告するGlxのADCは、他の代謝物質と同様、非梗塞半球よりも梗塞半球において有意に低下していたが、他の代謝物質の低下率と比較し軽微な変化であり、虚血の際の感受性の高いマーカーとはなり得ないと考えられる。
非梗塞半球のADCは、2時間後に比べ8時間後にはCho 21%、Cre 9%、NAA 18%それぞれ低下している。梗塞半球における変化率と比べると、Cho及びCreの変化率は小さく、NAAは8時間後には梗塞半球におけるADCとほぼ等しいほど低下している。梗塞半球においては虚血のマーカーとして鋭敏であったCreのADCの変化率は、8時間後の時点でCho及びNAAよりも低値を示しており、diaschisisのマーカーとしては、Cho及びNAAの感受性が高い結果になった。梗塞発症後24時間以内の動物モデルでは、脳血流及び局所酸素代謝、グルコース代謝などの代謝は低下する報告が多いが、代謝物質ADCの低下もこれらtranshemispheric diaschisisの一部と思われる。その機序については本研究のみでは明らかにできず、更なる検討が必要と思われる。
e.まとめ a-1)で述べた目的に対する結論は以下の通りである。
1)梗塞半球における各代謝物質のADCは早期より低下しており、なかでもcholine containing compounds及びcreatine/phosphocreatineのADCは経時的に減少し、虚血における細胞障害の程度の示標となる可能性が示唆された。急性期梗塞において細胞内自由水が代謝物質と同様な機序で反応するならば、自由水ADCの低下には、細胞外液腔自由水のADC低下、細胞外液量の減少ばかりではなく、細胞内自由水のADCの低下も関与することが示唆された。
2)非梗塞半球におけるcholine containing compounds、creatine/phosphocreatine、N-acetylaspartateのADCは経時的に低下し、大脳半球梗塞における非梗塞半球へのtranshemispheric diaschisisを表すものと思われた。
3)梗塞部検出の鋭敏な示標は、choline containing compounds及びcreatine/phosphocreatineのADCの2者と思われた。またdiaschisis検出のマーカーとしては、choline containing compounds及びN-acetylaspartateの2者が鋭敏と思われた。glutamine/glutamateのADCは非梗塞半球に比べ梗塞半球で低下するものの、その低下率は小さく、虚血に対する鋭敏なマーカーとはなり得ないと思われた。
以上の結果を踏まえ、
4)自由水に比べ代謝物質のADC測定は、現段階では時間・空間分解能の点で劣るものの、虚血部検出に関する鋭敏性では勝っており、測定機器・技術の改良により前述の欠点が解消されれば、臨床的に不可逆性梗塞部、penumbra、健常部を非侵襲的に鑑別できる可能性があり、超急性期脳梗塞患者の診断及び治療法の選択に対して大きなインパクトを与えることが期待される。
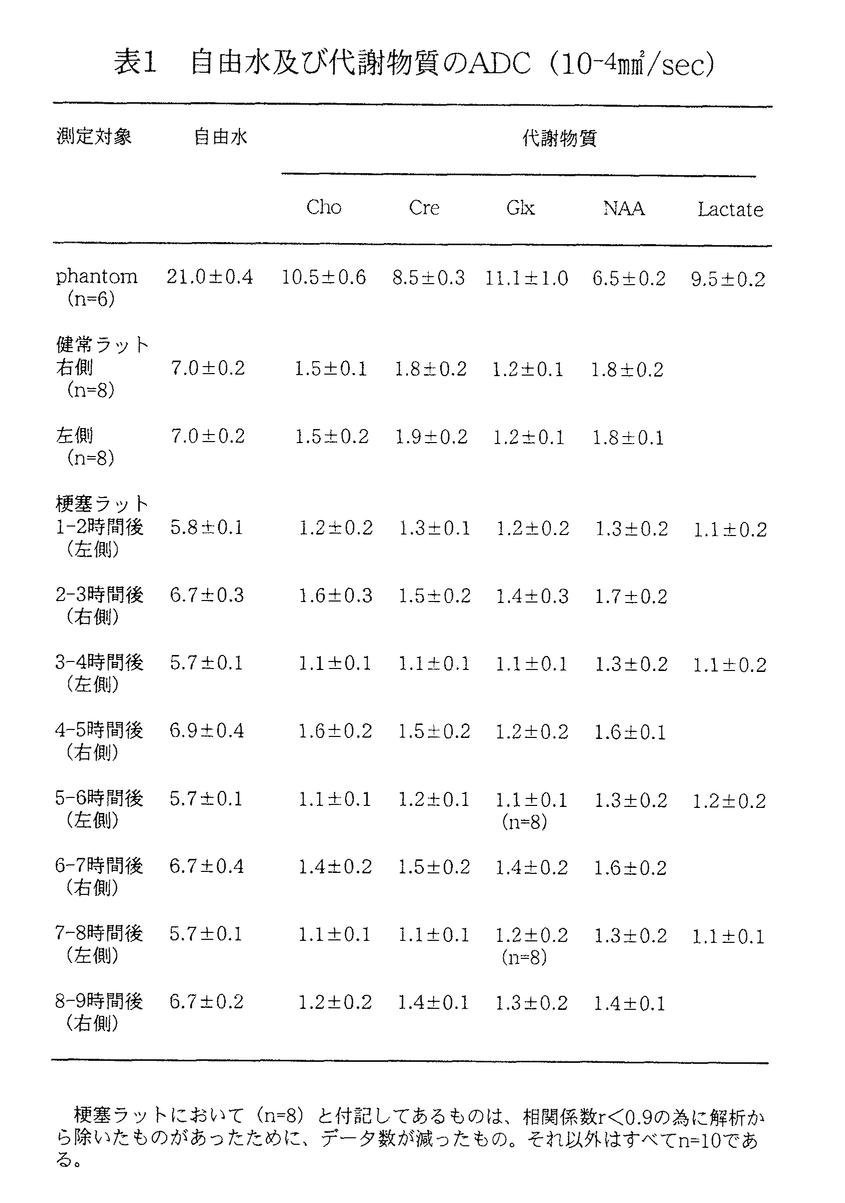 表1 自由水及び代謝物質のADC(10-4mm2/sec)梗塞ラットにおいて(n=8)と付記してあるものは、相関係数r<0.9の為に解析から除いたものがあったために、データ数が減ったもの。それ以外はすべてn=10である。
表1 自由水及び代謝物質のADC(10-4mm2/sec)梗塞ラットにおいて(n=8)と付記してあるものは、相関係数r<0.9の為に解析から除いたものがあったために、データ数が減ったもの。それ以外はすべてn=10である。