| 内容要旨 | | [序説] ブルトン型チロシンキナーゼ(Btk)はヒトの伴性無 グロブリン血症(XLA)及びマウスの伴性免疫不全症(Xid)の原因遺伝子として同定された非レセプター型チロシンキナーゼで、Itk,Tec,Bmxなどとともに非レセプター型チロシンキナーゼの新しいサブファミリー(Tecファミリーキナーゼ)を形成している。Tecファミリーキナーゼは構造上そのN末端側にBtk相同領域(BH領域)と呼ばれるユニーク領域を持つことからSrc型のチロシンキナーゼとは大別することができる。 グロブリン血症(XLA)及びマウスの伴性免疫不全症(Xid)の原因遺伝子として同定された非レセプター型チロシンキナーゼで、Itk,Tec,Bmxなどとともに非レセプター型チロシンキナーゼの新しいサブファミリー(Tecファミリーキナーゼ)を形成している。Tecファミリーキナーゼは構造上そのN末端側にBtk相同領域(BH領域)と呼ばれるユニーク領域を持つことからSrc型のチロシンキナーゼとは大別することができる。 XLAの患者では末梢血中の成熟B細胞数(結果的に免疫グロブリン数)が顕著に減少しているため、BtkはプレB細胞から成熟B細胞への増殖・分化の過程に重要な役割を果たしているものと考えられている。XLA患者に見られるBtk遺伝子の異常(点変異・欠失・挿入など)はその全長にわったて存在することが知られている。特にBtk遺伝子内のミスセンス変異によってもXLAが引き起こされることからXLAミスセンス変異はBtkタンパク内の機能上重要な位置を示していることが想像される。このXLAミスセンス変異はBH領域のN末端近くの狭い領域及びキナーゼ領域後半に集積しているため、BH領域はBtkの機能発現に重要な領域であると考えられているがBH領域のリガンドなどその詳細は明らかでない。先に筆者らはRas GAP(GTPase-activating protein;低分子量GTP結合タンパク質RasのGTPase活性を促進する因子)の一種であるGAP1mのBH領域がイノシトール1,3,4,5-四リン酸(Ins1,3,4,5-P4)と結合することを見出していた。そこでBtk BH領域もIns 1,3,4,5-P4と結合し、その結合がXLAミスセンス変異により影響を受けるのではないかと考え、その詳細を検討した。 [結果・考察]1.Btk BH領域のイノシトールリン酸及びイノシトールリン脂質結合特異性 マウス脾臓から得られたcDNAをもとにBtk BH領域をグルタチオンS-トランスフェラーゼ(GST)との融合蛋白質(GST-Btk-BH)として大腸菌で発現させアフィニティーカラムにより精製した。このGST-Btk-BHと3Hで標識されたIns 1,3,4,5-P4([3H]Ins 1,3,4,5-P4)との結合実験を行なったところGST-Btk-BHはIns 1,3,4,5-P4と結合することがわかった。なお、コントロールのGSTのみでは有意な結合は見られなかった。そこで次にGST-Btk-BHとIns 1,3,4,5-P4との親和性を調べるため非標識のIns 1,3,4,5-P4を用いてGST-Btk-BHと[3H]Ins 1,3,4,5-P4結合の競合阻害実験を行った。その結果Btk BH領域はIns 1,3,4,5-P4に対し高い親和性(Kd=9.5nM)を有することが明らかになった(図1)。 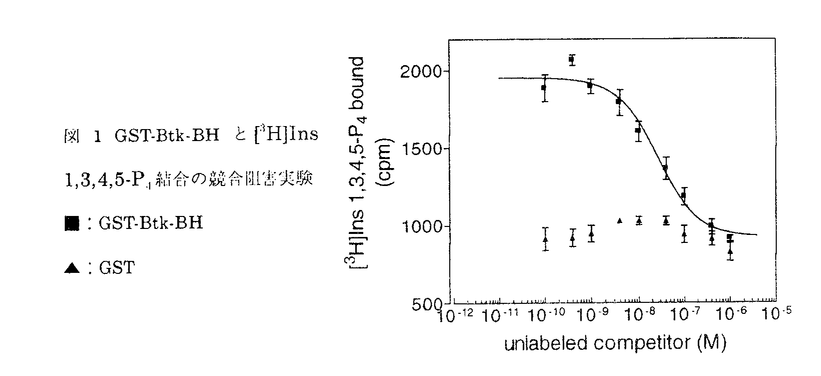 図 1 GST-Btk-BHと[3H]Ins 1,3,4,5-P4結合の競合阻害実験■:GST-Btk-BH ▲:GST 図 1 GST-Btk-BHと[3H]Ins 1,3,4,5-P4結合の競合阻害実験■:GST-Btk-BH ▲:GST また、種々のイノシトールリン酸、イノシトールリン脂質を用いた同様の競合阻害実験により、Btk BH領域は、Ins 1,3,4,5-P4よりも低親和性であるがイノシトール1,3,4,5,6-五リン酸(InsP5)、イノシトール六リン酸(InsP6)、ホスファチジルイノシトール3,4,5-三リン酸(PtdIns 3,4,5-P3)をも結合し得ることが示された。 2.変異体Btk BH領域のIns 1,3,4,5-P4結合特性 Btk BH領域とIns 1,3,4,5-P4との結合に対するXLA及びXidミスセンス変異の影響を調べるため、XLAあるいはXidにおいて報告されているBH領域内ミスセンス変異、六種類(F25S(25番フェニルアラニンのセリンへの置換),R28C,R28H,T33P,V64F,V113D)を導入した変異体GST-Btk-BHを調製し、[3H]Ins 1,3,4,5-P4との結合実験を行った。その結果、いずれの点突然変異体においてもIns 1,3,4,5-P4に対する親和性が低下していることが示された。この結果について筆者らは、PLC- 1とIns 1,4,5-P3の結合体のX線結晶構造解析結果との比較から、結合実験上弱いながらもIns 1,3,4,5-P4との結合が認められたF25S,R28C,R28H変異体においてはIns 1,3,4,5-P4のリン酸基との結合が乱され、Ins 1,3,4,5-P4との結合が認められなかったT33P,V64F,V113D変異体においてはBH領域の構造が不安定化しているものと予測したが、これは最近のBtk BH領域のX線結晶構造解析結果によっても支持されている。以上によりXLA及びXid発症とIns 1,3,4,5-P4結合活性に何らかの関連が有ることが示唆された。 1とIns 1,4,5-P3の結合体のX線結晶構造解析結果との比較から、結合実験上弱いながらもIns 1,3,4,5-P4との結合が認められたF25S,R28C,R28H変異体においてはIns 1,3,4,5-P4のリン酸基との結合が乱され、Ins 1,3,4,5-P4との結合が認められなかったT33P,V64F,V113D変異体においてはBH領域の構造が不安定化しているものと予測したが、これは最近のBtk BH領域のX線結晶構造解析結果によっても支持されている。以上によりXLA及びXid発症とIns 1,3,4,5-P4結合活性に何らかの関連が有ることが示唆された。 BtkにはBH領域内1アミノ酸置換によって活性型になる変異体(E41K変異体)Btk*が報告されている。Ins 1,3,4,5-P4結合活性に対するこの変異の影響を調べるためE41K変異をBH領域に導入し、同種競合阻害実験によりE41K変異体(GST-Btk-BH(E41K))のIns 1,3,4,5-P4に対する親和性を調べた(図2)。その結果GST-Btk-BH(E41K)は野生型よりもIns 1,3,4,5-P4に対して低い親和性を持つことが示された(Kd=26.4 nM)。また、異種競合阻害実験によって、野生型とは異なりE41K変異体はInsP6に対してはIns1,3,4,5-P4と同程度の親和性を持つことも明らかになった。Ins 1,3,4,5-P4に対する親和性の低下は先の実験によってXLA及びXid変異体においても起きていることが示唆されている。この点についてはさらに詳細な検討が必要である。 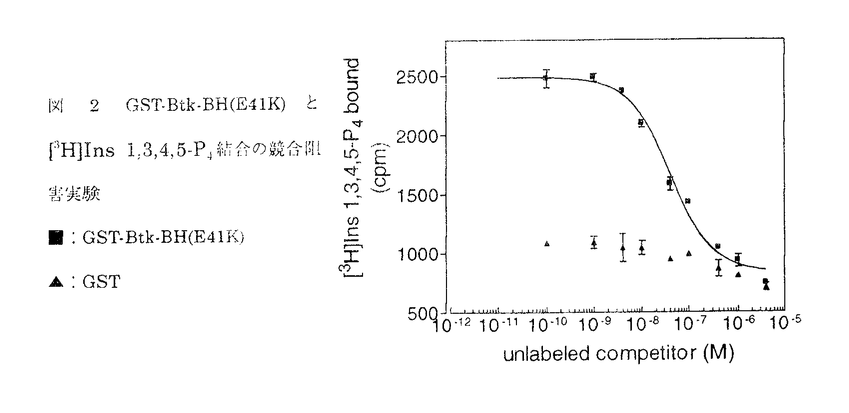 図 2 GST-Btk-BH(E41K)と[3H]Ins 1,3,4,5-P4結合の競合阻害実験■GST-Brk-BH(E41K) ▲:GST 図 2 GST-Btk-BH(E41K)と[3H]Ins 1,3,4,5-P4結合の競合阻害実験■GST-Brk-BH(E41K) ▲:GST |
| 審査要旨 | | 本研究は近年新たな生理活性物質として注目されているイノシトール1,3,4,5-四リン酸(Ins 1,3,4,5-P4)の生理作用を明らかにするため、その新規結合部位として、ヒトの伴性無 グロブリン血症(XLA)及びマウスの伴性免疫不全症(Xid)の原因遺伝子として同定されたブルトン型チロシンキナーゼ(Btk)のBtk相同領域(BH領域)に着目し、大腸菌で発現させたグルタチオンS-トランスフェラーゼ(GST)との融合タンパク質(GST-Btk-BH)を用いて、野生型及び変異体Btk BH領域のIns 1,3,4,5-P4に対する親和性を検討したものであり、下記の結果を得ている。 グロブリン血症(XLA)及びマウスの伴性免疫不全症(Xid)の原因遺伝子として同定されたブルトン型チロシンキナーゼ(Btk)のBtk相同領域(BH領域)に着目し、大腸菌で発現させたグルタチオンS-トランスフェラーゼ(GST)との融合タンパク質(GST-Btk-BH)を用いて、野生型及び変異体Btk BH領域のIns 1,3,4,5-P4に対する親和性を検討したものであり、下記の結果を得ている。 1. GST-Btk-BHと3Hで標識されたIns 1,3,4,5-P4([3H]Ins 1,3,4,5-P4)との結合実験及び非標識のIns 1,3,4,5-P4を用いた競合阻害実験の結果、Btk BH領域はIns 1,3,4,5-P4に対し高い親和性(Kd=9.5nM)を有することが示された。また、種々のイノシトールリン酸、イノシトールリン脂質を用いた同様の競合阻害実験により、Btk BH領域は、Ins1,3,4,5-P4よりも低親和性であるがイノシトール1,3,4,5,6-五リン酸、イノシトール六リン酸(InsP6)、ホスファチジルイノシトール3,4,5-三リン酸をも結合し得ることが示された。 2. XLAあるいはXidにおいて本研究進行当時報告されていた全てのBH領域内ミスセンス変異を導入した変異体GST-Btk-BHを調製し、[3H]Ins 1,3,4,5-P4との結合実験を行った。その結果、いずれの点突然変異体においてもIns 1,3,4,5-P4に対する親和性が低下していることが示された。 3. BtkにはBH領域内1アミノ酸置換によって活性型になる変異体(E41K変異体)Btk*が報告されている。このE41K変異体(GST-Btk-BH(E41K))のIns 1,3,4,5-P4に対する親和性を同種競合阻害実験により調べた。その結果、GST-Btk-BH(E41K)はIns1,3,4,5-P4に対して野生型よりも低い親和性を持つことが示された(Kd=26,4nM)。また、異種競合阻害実験によって、野生型とは異なりE41K変異体はInsP6に対してはIns1,3,4,5-P4と同程度の親和性を持つことも示された。 以上、本論文は大腸菌で発現させたGST融合タンパク質を用いて、Ins 1,3,4,5-P4との結合実験から、Ins 1,3,4,5-P4がBtk BH領域の生理的なリガンドであることを示唆するものである。本研究はこれまで不明な点の多かった、Btkを介する細胞内シグナル伝達系の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |