本研究は、哺乳類の神経系発生の分子メカニズムを理解する目的で、生後のマウス小脳の発達に関わる遺伝子群の探索を試みたものであり、下記の結果を得ている。 1. マウス生後発達期(E18,P0,P3,P7,P12,P15,P21,Adult)の小脳において、32セットのプライマーを用いた蛍光ディファレンシャルディスプレイ(FDD)により約2000種の発現遺伝子群を比較し、発達段階で発現変化のあった遺伝子を136種検出した。発現に変化のあったもののなかで、35種のFDDフラグメントをクローニングし、その塩基配列(いずれも3’末端側の部分塩基配列)を決定したところ、16種がデータベース登録済みの既知遺伝子で、19種が未登録の新規遺伝子であった。既知遺伝子のなかには、PCNA,Tau,Alpha Tublin,Mitochondrial cytochrome C,P400,PLP,MOBP,GIRK3,K-ATPase,Aldehyde dehydrogenase,ribosomal RNAなどが検出された。 2. 新規のクローンに関しては、中枢神経系特異的なものが11種、そのうち小脳特異的なものが3種、存在した。さらにDIG標識によるin situハイブリダイゼーションを行った結果、各クローン特有の発現分布が検出され、その発現時期にその細胞で起こる事象と関連があると考えられた。 3. 新規の遺伝子群のなかで、P7の時期に一過性に強く発現するクローン「13-2」について、解析を進めた。小脳において13-2は、P3時には外顆粒層にもっとも強く発現し、移動中の顆粒細胞と思われる内顆粒層側に向かう細胞にも発現が認められた。P7時には、内顆粒層での発現が優位となり、P12時には外・内顆粒層ともに弱まり、P15時以降は全く検出されなかった。したがって、13-2は小脳顆粒細胞の動的変化に関与している可能性が高いと考えられた。 4. 13-2mRNAは約1.8Kbpの長さで、蛋白質として343アミノ酸から構成され全体的に親水性の高い構造をもち、N末端から約90番目のアミノ酸からC末端にかけて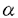 -ヘリックスに富み、coiled-coil構造を持つ可能性が高いと推測された。モチーフとしては、N末端側80番目に膜蛋白質のクラスタリングに関与するPDZドメイン・コンセンサス配列(RXXXXGLGF)、C末端側に4個のロイシンジッパー様配列を有していた。ホモロジー検索にかけた結果、N末端側1〜120番目まで、Homer/Vesl(シナプス活動依存的に一過性に発現する早初期遺伝子でmGluR1,5と結合するものとして報告されている)とほぼ一致し、110番目〜C末端まで、Citron(低分子量GTPaseであるRho/Racの標的タンパクとして報告されている)のRho結合領域付近と緩いホモロジーがあった。 -ヘリックスに富み、coiled-coil構造を持つ可能性が高いと推測された。モチーフとしては、N末端側80番目に膜蛋白質のクラスタリングに関与するPDZドメイン・コンセンサス配列(RXXXXGLGF)、C末端側に4個のロイシンジッパー様配列を有していた。ホモロジー検索にかけた結果、N末端側1〜120番目まで、Homer/Vesl(シナプス活動依存的に一過性に発現する早初期遺伝子でmGluR1,5と結合するものとして報告されている)とほぼ一致し、110番目〜C末端まで、Citron(低分子量GTPaseであるRho/Racの標的タンパクとして報告されている)のRho結合領域付近と緩いホモロジーがあった。 5. 13-2蛋白質のHomer/Veslとホモロジーのあった領域は、成長円錐においてFアクチンのproximal部位に局在するとの報告があるEVH1ドメインともホモロジーがあり、実際、大腸菌に発現させたGST融合13-2蛋白質とFアクチンは直接結合することが、Fアクチンとの共沈殿実験によって明らかになった。 6. 13-2蛋白質に対するRhoA/Rac1/Cdc42によるリガンドオーバーレイ実験では、特にGTP結合型Rac1/Cdc42との親和性が示唆された。 7. COS7細胞に、GFP融合13-2蛋白質を一過性に発現させたところ、細胞質全体にわたって斑点様の局在が観察された。 以上、本論文は、マウス小脳の生後発達期に発現量の変化する未知および既知の遺伝子群を記載し、また特に、小脳顆粒細胞の動態がドラスティックに変化する時期に一過性に発現する新規の遺伝子「13-2」の存在を明らかにした。本研究におけるこの新規蛋白質の発見は、顆粒細胞動態変化の分子機序の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |