| 内容要旨 | | 1.はじめに 脳切片培養系は正常脳に近い細胞構築を保っていること,正常神経細胞により近い性質を持つ点において単離細胞培養より優れている.またin vivoに比して薬理学的研究などが容易であるという培養系の利点は保持している.さらに正常投射系組織の共培養により正常脳に見られる神経回路を形成させうることがすでに示されており軸索伸長や成長因子などと関連した神経発生などの研究系として優れている. 皮質脊髄路は大脳皮質からの主要な遠心路であり筋萎縮性側索硬化症,多系統萎縮症等の神経変性疾患や脳梗塞等の血管障害において好んで侵され,この経路の生物学的特性を明らかにすることは臨床的にも極めて重要である.この経路は皮質運動野・体性感覚野の起始細胞より脳幹・脊髄に至るがヒトでは脊髄側索を通り,ラットでは後索を通る.発生学的にはラットではE14-E16に起始細胞が発生し,交叉線維ではおおよそP0で錐体交叉,P1で頸髄から上部胸髄,P5で第1/2腰髄,P9で仙髄に達する. 本研究ではin vivoと同時期の発生過程にある脳切片の共培養系を用い,皮質脊髄投射がin vitroにおいて形成されうることをまず形態学的手法を用いて示した.次いで電気生理学的手法を用いてこの皮質脊髄投射線維と脊髄ニューロン間とのシナプス結合を証明し,その薬理学的性質について検討を加えた. 2.方法1)切片共培養 幼若ラットより大脳皮質(P0-P2),橋(P0),脊髄(P0-P2)を取り出し,大脳皮質運動感覚野前肢・後肢領域(前額断),橋腹側,脊髄(頚髄・腰髄)(水平断)をマイクロスライサーを用い400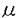 m厚に薄切し皮質の白質および脊髄周囲の白質を除去した.その後,ホルモン等を加えた培養液上の多孔質膜上に各切片を近接して静置し,5%CO2/95%air,37℃にて14-28日間培養した. m厚に薄切し皮質の白質および脊髄周囲の白質を除去した.その後,ホルモン等を加えた培養液上の多孔質膜上に各切片を近接して静置し,5%CO2/95%air,37℃にて14-28日間培養した. 2)形態学的検索 この共培養組織を位相差顕微鏡にて観察し,また培養開始後10-17日後にバイオサイチンを大脳皮質上に静置し皮質内細胞体および軸索を順行性に標識した.固定後,ABC法を用いて可視化し光学顕微鏡により観察した.逆行性標識のために固定後DiIを脊髄上に静置し室温にて5-10日間おき,蛍光顕微鏡にて観察した.もしくは培養開始後10-17日後にHRPを脊髄上に静置し逆行性に標識した.固定後,DABを用いて可視化し光学顕微鏡により観察した. また,次項で述べる細胞内記録後に記録電極よりニューロン内に2%バイオサイチン/1.5M KClを注入し,固定後上記と同様にして可視化し観察した. 3)電気生理学的検索 14-28日間培養した脳切片共培養組織を多孔質膜とともに切り出し記録用チェンバー内に置き,リンガー液(NaCl:124mM,KCl:5mM,NaH2PO4:1.2mM,NaHCO3:26mM,MgSO4:1.29mM,CaCl2:2.4mM)にて37℃で灌流し大脳皮質深層に刺激電極(白金-イリジウム線)を刺入して皮質脊髄投射線維を刺激し,脊髄灰白質よりガラス管微小電極を用いて細胞外記録(2M NaCl,0.8-2M )および細胞内記録(3M KCl,65-80M )および細胞内記録(3M KCl,65-80M )を行った.シナプス伝達を阻害するために無Ca2+/高Mg2+液(MgSO4:5mM)を灌流した.またNMDA受容体を阻害するために100 )を行った.シナプス伝達を阻害するために無Ca2+/高Mg2+液(MgSO4:5mM)を灌流した.またNMDA受容体を阻害するために100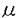 M DL-AP5,AMPA/KA受容体を阻害するために20 M DL-AP5,AMPA/KA受容体を阻害するために20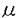 M CNQX,GABAA受容体阻害のために100 M CNQX,GABAA受容体阻害のために100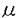 M bicuculline,Glycine受容体阻害のために200 M bicuculline,Glycine受容体阻害のために200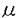 M strychnineを灌流した. M strychnineを灌流した. 3.結果 1)大脳皮質,橋,脊髄の3者の共培養において,橋を用いずに大脳皮質-脊髄間に結合が直接形成された.順行性の標識において,皮質から脊髄に向かって伸長し脊髄内部に到達する多数の投射線維が認められた.DiI,HRPにより大脳皮質内からの投射線維が逆行性に標識され,それらの起始細胞である大脳皮質内の錐体細胞と思われる大型細胞が標識された.これら逆行性に標識された細胞の皮質層構造における位置は概ね深層であったが一部表層に近い位置に,脊髄へ軸索をのばしている起始細胞を認めた. 大脳皮質の前肢領域・後肢領域と脊髄頸・腰髄間の4つの組み合わせで皮質-脊髄共培養を行い部位特異性を検討したが,明らかな部位特異性は認められず,いずれの組み合わせにも脊髄への線維の伸長は認められた. 細胞内記録時における染色では,染色された細胞には多極性の大型細胞(n=7)とその他のやや小型の細胞(n=14)が認められた.この多極性細胞細胞体の大きさは(29.6±4.1)x(17.0±3.3)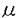 mであり脊髄運動ニューロンと考えられる. mであり脊髄運動ニューロンと考えられる. 2)電気生理学的には細胞外記録において,リンガー液灌流下に脊髄灰白質内で,鋭い陰性の電位変動と緩徐電位変動(陽性または陰性)を認めた.無Ca2+/高Mg2+液を灌流しシナプス伝達を阻害すると鋭い陰性電位変動は変化しなかったが,緩徐電位変動は消失した.これよりこの鋭い陰性電位変動は恐らくシナプス前線維の活動電流による電位であり,緩徐電位変動(陽性,陰性)はシナプス後電流による細胞外電場電位と考えられる.後者のシナプス電位はAP5,bicuculline,strychnineの投与によってはほとんど変化しなかったがCNQXを投与すると消失した.さらに細胞内記録において,EPSPを観察し同様の薬理学的性質を示した.細胞外記録のシナプス前性電位から求めた神経伝導速度は31.9±14.1cm/secであり,このことから大脳皮質-脊髄間の投射線維は無髄線維であると考えられる.この神経伝導速度と,細胞内記録時のEPSP潜時との差から求めたシナプス遅延は1.26±1.08msであった.幼弱期ではシナプス遅延が成体より長いという報告を考え合わせると観察されたシナプス結合には単シナプス性結合が含まれると考えられる. 大脳皮質の前肢領域・後肢領域と脊髄頸・腰髄間の4つの組み合わせの部位特異性は電気生理学的にも認められず,上記のいずれの組み合わせにおいても皮質刺激により脊髄内でシナプスを介した電位が観測された.さらにこれらのfield potentialの振幅を用いて定量的に検討を加えたが上記4つの組み合わせの間に有意差は認められなかった. 4.考察 幼弱ラットを用いて大脳皮質および脊髄の切片から機能的シナプスを持つ皮質脊髄投射系を形成することができた.皮質脊髄間の共培養において機能的シナプスを形成させたのは本研究が初めてである. 軸索の伸長については様々なメカニズムが考えられ,軸索が伸長する際には途中に橋頭堡が必要であるという考えや実例もあるが,本系では橋などの中間経路を用いずに機能的シナプスを形成させ得た. 大脳皮質と脊髄レベルの間の特異性に関しては皮質前肢領域と頚髄,皮質後肢領域と腰髄の間に各々特異性が認められ,適合しない組合せでは線維は白質で停止し灰白質内には進入しないという報告がある.また,灰白質には部位特異性のない拡散性の誘因物質があると考えられている.このことから,灰白質に至るまでは誘因性の物質が影響し,灰白質内では直接の接触性作用により軸索のガイダンスを制御し,異なる領域の大脳皮質線維は灰白質内に侵入しにくいものと考えられる.本研究によりP0-P2においては,invivoとは異なる皮質投射領域からの軸索は脊髄に侵入するだけではなく,電気生理学的にも皮質の領域と脊髄レベルの組合せとは無関係に機能的シナプスを形成することが示された.これは上記の報告ではP5-P8の脊髄を用いているが,本研究ではP0-2の脊髄を用いており,発達時期の違いにより灰白質における制御が異なる事も考えられる. また今回,皮質脊髄投射のシナプス後細胞であることが電気生理学的に確認された細胞には単シナプス結合のものが含まれると考えられ,バイオサイチンの細胞内注入により染色された細胞も形態学的に運動ニューロンと考えられるものが相当数認められている.in vivoラットでは皮質-脊髄運動ニューロンの結合は大部分は介在ニューロンを介して結合するがごく一部で単シナプス結合も存在するとされており,本系でのシナプスはin vivoのシナプス形成を一部反映するのみならず,皮質脊髄投射線維が直接脊髄運動ニューロンに結合する能力を潜在的に十分保持していることを示している. 今回形成されたシナプスにより発生する電位は細胞外記録で電場電位が明瞭に観察されており,多数の線維が同期して活動していることが示唆される.またAP5,CNQXの投与結果より,このシナプスは主としてグルタミン酸を伝達物質とし,AMPA/KA型受容体を介していると考えられる.細胞内記録時の陽性電位の解釈として,幼弱期におけるCl-平衡電位が静止膜電位より脱分極側にある可能性やKCl電極から細胞内へのCl-の流入により,GABAA受容体,Glycine受容体を介したIPSPが脱分極性の電位変動を示していた可能性も考えられたがbicuculline,strychnineによってこの電位が大きな影響を受けなかったことから,このような可能性は否定できる. in vitroにおいて機能的シナプスを持つ皮質脊髄投射系が形成されたことにより,生化学的・薬理学的な実験系としての有利さを持つだけでなく遺伝子の導入などの応用もできることから,本系は発生学的な研究だけでなく各種神経疾患の病態・病因の解明や治療法の研究にも極めて有用であると考えられる. |
| 審査要旨 | | 本研究は大脳皮質からの主要な遠心路であり神経変性疾患,脳血管障害などにおいて好んで侵され,臨床的にも極めて重要である皮質脊髄投射をin vitroで形成させることを目的とした.in vivoと同時期の発生過程にある脳切片の共培養系を用いて,皮質脊髄投射線維と脊髄ニューロン間とのシナプス結合を形態学的手法および電気生理学的手法を用いて証明することにより,皮質脊髄投射がin vitroにおいて形成されうることを示し,その薬理学的性質,投射部位特異性について検討を加えた. 1.幼弱ラットから取り出し薄切した大脳皮質,橋,脊髄の3者の共培養において,橋を用いずに大脳皮質-脊髄間に結合が直接形成された.順行性の標識において,皮質から脊髄に向かって伸長し脊髄内部に到達する多数の投射線維が認められた.DiI,HRPにより大脳皮質内からの投射線維が逆行性に標識され,それらの起始細胞である大脳皮質内の錐体細胞と思われる大型細胞が標識された.これら逆行性に標識された細胞の皮質層構造における位置は概ね深層であったが一部表層に近い位置に,脊髄へ軸索をのばしている起始細胞を認めた. 2.大脳皮質-脊髄共培養において皮質深層を刺激し,脊髄灰白質内からガラス管微小電極を用いて記録し電気生理学的に検討した.細胞外記録において,無Ca2+/高Mg2+液を灌流しシナプス伝達を阻害した結果から,脊髄灰白質内で恐らくシナプス前線維の活動電流によると思われる電位とシナプス後電流による細胞外電場電位を認めた.これらのことから多数の線維が同期して活動していることが示唆された.後者のシナプス電位はAP5,bicuculline,strychnineの投与によってはほとんど変化しなかったがCNQXを投与すると消失した.さらに細胞内記録において,EPSPを観察し同様の薬理学的性質を示した.このことからこのシナプスは主としてグルタミン酸を伝達物質とし,AMPA/KA型受容体を介していると考えられる.細胞外記録のシナプス前性電位から求めた神経伝導速度は31.9±14.1cm/secであり,このことから大脳皮質-脊髄間の投射線維は無髄線維であると考えられる.この神経伝導速度と,細胞内記録時のEPSP潜時との差から求めたシナプス遅延は1.26±1.08msであった.幼弱期ではシナプス遅延が成体より長いという報告を考え合わせると観察されたシナプス結合には単シナプス性結合が含まれると考えられる. 3.細胞内記録時にEPSPを観察した細胞にbiocytinを注入し染色したところ,多極性の大型細胞(n=7)とその他のやや小型の細胞(n=14)が認められた.この多極性細胞は大きさ,形態から脊髄運動ニューロンと考えられる.ラットin vivoでは皮質脊髄路線維と脊髄運動ニューロンの単シナプス結合は極めてまれであるが,本系で観察されたシナプス結合には単シナプス性結合が含まれるという結果を考え合わせると,ラットの皮質脊髄投射線維が脊髄運動ニューロンに直接結合する能力を潜在的に十分保持していることを示している. 4.大脳皮質の前肢領域・後肢領域と脊髄頸・腰髄間の4つの組み合わせで皮質-脊髄共培養を行い部位特異性を検討した.いずれの組み合わせにおいても皮質刺激により脊髄内でシナプスを介した電位が観測された.さらにこのfield potentialの振幅を用いて定量的に検討を加えたが上記4つの組み合わせの間に有意差は認められなかった.本研究によりラットP0-P2においては,in vivoとは異なる皮質投射領域からの軸索は脊髄に侵入するだけではなく,電気生理学的にも皮質の領域と脊髄レベルの組合せとは無関係に機能的シナプスを形成することが示された. 以上,本論文はin vitroにおいて機能的シナプスを持つ皮質脊髄投射系を形成することに成功した.本系は生化学的・薬理学的な実験系としての有利さを持つだけではなく遺伝子の導入などの応用もできうることから,発生学的な研究だけでなく各種神経疾患の病態・病因の解明や治療法の研究に重要な貢献をなすものと考えられ,学位の授与に値するものと考えられる. |