本研究の目的は、ラットバルーン血管傷害モデルにおいて、1)PDGFを含め報告されている細胞増殖因子が実際内膜肥厚の過程で活性化されているかを、in vivoで受容体自己リン酸化および受容体キナーゼ基質のチロシンリン酸化の定量によって評価し、2)AII選択的受容体拮抗薬、TCV-116、を用い内膜肥厚およびこれに伴う上記受容体チロシンリン酸化にたいする効果を検討することにより、細胞増殖因子受容体活性化とAIIとの関連を明らかにすること、さらに3)Directional coronary atherectomy(DCA)のサンプルを用いヒト動脈硬化巣におけるPDGF受容体活性化と再狭窄および種々の臨床指標との関連性を検討し、内膜肥厚における細胞増殖因子受容体活性化の意義を明らかにすることであり、下記の結果を得ている。 1.ラットバルーン血管傷害モデルにおける内膜肥厚は術後7日より明らかとなり14日後にフラトーに達した。PDGF-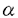 ,- ,-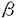 両受容体のチロシンリン酸化は傷害血管において検出可能であった。その値はバルーン血管傷害後7-14日に最大レベルに達し、28日後までには対照レベルに低下した。PDGF- 両受容体のチロシンリン酸化は傷害血管において検出可能であった。その値はバルーン血管傷害後7-14日に最大レベルに達し、28日後までには対照レベルに低下した。PDGF-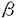 受容体の発現量は全期間を通じて著名な変化は認められなかった。一方、インシュリン,またはIGF-1の受容体チロシンキナーゼの基質であるIRS-1およびEGF,HB-EGFの受容体となるEGF受容体のチロシンリン酸化レベルは術後14日以内では著名な変化は認められなかった。 受容体の発現量は全期間を通じて著名な変化は認められなかった。一方、インシュリン,またはIGF-1の受容体チロシンキナーゼの基質であるIRS-1およびEGF,HB-EGFの受容体となるEGF受容体のチロシンリン酸化レベルは術後14日以内では著名な変化は認められなかった。 2.AIIのPDGF受容体活性化および内膜肥厚に対する影響を確かめる目的で、術前4日よりAIIのI型受容体選択的拮抗薬であるTCV-116を投与し術後14日におけるPDGF-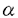 ,- ,-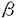 両受容体のチロシンリン酸化およびI/M比を検討した。AII拮抗薬は内膜肥厚をほぼ完全に抑制するとともにPDGF- 両受容体のチロシンリン酸化およびI/M比を検討した。AII拮抗薬は内膜肥厚をほぼ完全に抑制するとともにPDGF-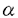 ,- ,-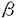 両受容体のチロシンリン酸化を完全に抑制した。これとは対照的にAII拮抗薬とほぼ同程度の降圧をひきおこすCa拮抗薬amlodipineは内膜肥厚を抑制せず、PDGF- 両受容体のチロシンリン酸化を完全に抑制した。これとは対照的にAII拮抗薬とほぼ同程度の降圧をひきおこすCa拮抗薬amlodipineは内膜肥厚を抑制せず、PDGF-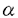 ,- ,-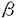 両受容体のチロシンリン酸化にも影響しなかった。AII受容体拮抗薬TCV-116はほぼ完全に内膜肥厚を抑制したため、この内膜肥厚の減少自体がPDGF受容体のチロシンリン酸化レベルの低下をひきおこす可能性を検討するため、内膜肥厚が術後14日の約70%のレベルに達する術後10日よりTCV-116の投与を開始し、投与開始後4日目にこのPDGF受容体チロシンリン酸化レベルに対する影響を非投与群と比較検討した。TCV-116はPDGF受容体のチロシンリン酸化を著明に低下させ、これと同時に内膜肥厚の増加を抑制した。 両受容体のチロシンリン酸化にも影響しなかった。AII受容体拮抗薬TCV-116はほぼ完全に内膜肥厚を抑制したため、この内膜肥厚の減少自体がPDGF受容体のチロシンリン酸化レベルの低下をひきおこす可能性を検討するため、内膜肥厚が術後14日の約70%のレベルに達する術後10日よりTCV-116の投与を開始し、投与開始後4日目にこのPDGF受容体チロシンリン酸化レベルに対する影響を非投与群と比較検討した。TCV-116はPDGF受容体のチロシンリン酸化を著明に低下させ、これと同時に内膜肥厚の増加を抑制した。 3.TCV-116を術前4日より連日経口投与し、術後14日における頚動脈のPDGFA,B鎖およびPDGF-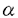 ,- ,-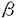 受容体mRNAの発現をノーザンブロット法で解析し非投与群と比較検討した。バルーン血管傷害自体は、軽度にPDGFA鎖のmRNAレベルを増加させるのみであった。TCV-116の投与により傷害血管においてPDGFA,B鎖およびPDGF- 受容体mRNAの発現をノーザンブロット法で解析し非投与群と比較検討した。バルーン血管傷害自体は、軽度にPDGFA鎖のmRNAレベルを増加させるのみであった。TCV-116の投与により傷害血管においてPDGFA,B鎖およびPDGF-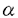 受容体mRNAの発現レベルは低下したが、PDGF- 受容体mRNAの発現レベルは低下したが、PDGF-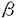 受容体mRNAレベルには変化は認められなかった。したがって、AII受容体拮抗薬(TCV-116)の投与によるPDGFA,B鎖およびPDGF- 受容体mRNAレベルには変化は認められなかった。したがって、AII受容体拮抗薬(TCV-116)の投与によるPDGFA,B鎖およびPDGF-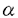 受容体mRNA発現レベルの低下はPDGF受容体チロシンリン酸化の抑制の一機序と考えられる。 受容体mRNA発現レベルの低下はPDGF受容体チロシンリン酸化の抑制の一機序と考えられる。 4.著明な動脈硬化が認められないLITA(n=15)とDCAサンプル(n=59)におけるPDGF-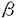 受容体のチロシンリン酸化を比較検討したところ、チロシンリン酸化レベルは各々0.17±0.08と0.84±0.67(mean±SD,p<0.0001)であり有意にDCAサンプルにおいて高値であった。これは冠動脈狭窄病変では正常血管と比較しPDGF- 受容体のチロシンリン酸化を比較検討したところ、チロシンリン酸化レベルは各々0.17±0.08と0.84±0.67(mean±SD,p<0.0001)であり有意にDCAサンプルにおいて高値であった。これは冠動脈狭窄病変では正常血管と比較しPDGF-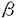 受容体のチロシンリン酸化のレベルが高値であることを示す。 受容体のチロシンリン酸化のレベルが高値であることを示す。 5.DCA後49病変に対しfollow-upの冠動脈造影を施行した。このうち15病変に再狭窄が認められ、再狭窄群と非狭窄群とのPDGF-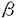 受容体のチロシンリン酸化を比較した場合、各々1.31±0.87と0.63±0.43(mean±SD,p<0.02)であり有意に再狭窄群で高値を示した。また、PDGF- 受容体のチロシンリン酸化を比較した場合、各々1.31±0.87と0.63±0.43(mean±SD,p<0.02)であり有意に再狭窄群で高値を示した。また、PDGF-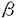 受容体のチロシンリン酸化はloss index(late loss/immediate gain)と良い相関を示した(r=0.664,p<0.0001)。しかし、immediate gainとは相関は認めなかった(r=0.201,p=0.17)。このことからPDGF- 受容体のチロシンリン酸化はloss index(late loss/immediate gain)と良い相関を示した(r=0.664,p<0.0001)。しかし、immediate gainとは相関は認めなかった(r=0.201,p=0.17)。このことからPDGF-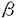 受容体のチロシンリン酸化はDCAの手技自体ではなくその再狭窄過程と関連していることが示唆された。 受容体のチロシンリン酸化はDCAの手技自体ではなくその再狭窄過程と関連していることが示唆された。 6.単回帰分析ではPDGF-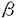 受容体のチロシンリン酸化と相関がみられたのは、不安定狭心症(p<0.0001)年齢(p=0.0012),と喫煙歴(p=0.0391)であった。これに対して変数選択-重回帰分析で相関が認められたのは不安定狭心症とコレステロール値で標準回帰係数により、不安定狭心症がPDGF- 受容体のチロシンリン酸化と相関がみられたのは、不安定狭心症(p<0.0001)年齢(p=0.0012),と喫煙歴(p=0.0391)であった。これに対して変数選択-重回帰分析で相関が認められたのは不安定狭心症とコレステロール値で標準回帰係数により、不安定狭心症がPDGF-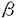 受容体のチロシンリン酸化ともっとも強い相関が認められることが示された。 受容体のチロシンリン酸化ともっとも強い相関が認められることが示された。 以上、本論文によりDCAサンプルにおいてもPDGF受容体がチロシンリン酸化されていることが初めて明らかになった。これと、DCA後の再狭窄過程と不安定狭心症との間に関連がみられたことは、バルーン血管傷害モデルのみならずヒト冠動脈硬化巣においてもPDGF受容体活性化が重要な役割を演じていることが考えられた。本研究はこれまで検討されたことのない内膜肥厚の発症、進展に重要な役割を演じるいわゆる"key factor"の解析に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |