本研究は、糸球体硬化の進展において重要だと考えられるメサンギウム細胞の形質変換の意義を明らかにするため、メサンギウム細胞における非筋型ミオシン重鎖アイソフォームの一つSMembの発現について検討しており、以下の結果を得ている。 1.ヒトIgA腎症を対象に、メサンギウム細胞のSMemb発現を組織学的、臨床的に検討した。さらに、従来からメサンギウム細胞の形質変換の一例として研究されていた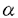 -actinの発現と比較した。 -actinの発現と比較した。 1)腎生検標本の連続切片を用いて、糸球体ごとに組織変化とSMemb、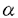 -actinの関係を検討した。PAS染色で糸球体組織障害を、免疫組織化学でSMemb、 -actinの関係を検討した。PAS染色で糸球体組織障害を、免疫組織化学でSMemb、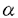 -actinの発現を、それぞれ半定量的に評価した。その結果、メサンギウム細胞のSMembの発現は、メサンギウム細胞の増殖およびメサンギウム基質の増加と関係していた。しかし、 -actinの発現を、それぞれ半定量的に評価した。その結果、メサンギウム細胞のSMembの発現は、メサンギウム細胞の増殖およびメサンギウム基質の増加と関係していた。しかし、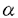 -actinの発現の発現は、メサンギウム細胞の増殖とは関係していたが、メサンギウム基質の増加との関係は明らかでなかった。本研究により、メサンギウム細胞のSMemb発現と糸球体組織障害との関係が初めて明らかにされた。また、SMembが糸球体の細胞外基質の蓄積と関係している可能性が示された。 -actinの発現の発現は、メサンギウム細胞の増殖とは関係していたが、メサンギウム基質の増加との関係は明らかでなかった。本研究により、メサンギウム細胞のSMemb発現と糸球体組織障害との関係が初めて明らかにされた。また、SMembが糸球体の細胞外基質の蓄積と関係している可能性が示された。 2)6年以上(平均8.6±1.5年間)、腎機能の予後を追跡したところ、メサンギウム細胞のSMembの発現は腎機能の予後と有意な相関があり、SMembがメサンギウム細胞に強く発現している症例は予後不良であった。しかし、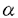 -actinの発現と腎機能の予後との間には有意な相関は認められなかった。本研究により、 -actinの発現と腎機能の予後との間には有意な相関は認められなかった。本研究により、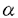 -actin、SMembの発現と長期予後との関係が明らかにされた。 -actin、SMembの発現と長期予後との関係が明らかにされた。 2.アンギオテンシンII(AII)は、メサンギウム細胞の細胞外基質産生を促進させることが知られているが、AII刺激によるメサンギウム細胞の形質変換について検討した。 1)培養メサンギウム細胞をAIIで刺激し、Western blot analysisでSMembの発現を観察したが、発現の変化は明らかでなかった。TGF-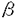 、PDGF、IL-6による刺激でも、同様の結果であった。これは、メサンギウム細胞は、培養すると形質変換し、無刺激でもSMembを強く発現するようになるためと考えられた。 、PDGF、IL-6による刺激でも、同様の結果であった。これは、メサンギウム細胞は、培養すると形質変換し、無刺激でもSMembを強く発現するようになるためと考えられた。 2)SDラットに浸透圧ミニポンプを埋め込み、AIIを持続皮下投与した。14日後に糸球体を単離し、Western blot analysisでSMembの発現を調べ、酵素免疫法でファイブロネクチンの定量を行った。この結果、AIIはメサンギウム細胞の形質を変換し、SMembを発現させることが示された。また、このSMembの発現は、ファイブロネクチンの増加を伴っていた。AT1受容体拮抗薬(TCV116)は、上記の変化を抑制した。よって、AIIはAT1受容体を介してメサンギウム細胞にSMembを発現させ、細胞外基質の産生を亢進させる可能性が考えられた。 本論文は、メサンギウム細胞におけるSMemb発現の組織学的、臨床的意義を明らかにした。また、SMembが糸球体における細胞外基質の蓄積と関係していることを初めて明らかにし、糸球体疾患の進行の機序の一端を解明するための道を拓いた点で、学位の授与に値するものと考えられる。 |