アドレノメデュリン(AM)は、1993年に北村らによりヒトの褐色細胞腫よりcAMP増加活性を指標としたアッセイ法によって分離同定されたペプチドで、その後の研究から、副腎のみならず、心臓、腎臓、肺、血管など広く循環器系の臓器に発現していることが分かり、血管作動性ペプチドとしての役割が注目されている。AMは、血管においては血管平滑筋及び内皮細胞にて産生され、強力な血管拡張作用にもとづく降圧作用を持つペプチドと考えられている。AMは、ヒト、ブタでは52個の、ラットでは50個のアミノ酸残基からなり、分子内に一つのジスルフィド結合によって形成される環状部分を持ち、C末端はアミド化されているという特徴を有し、この基本構造は同じく強力な血管拡張物質であるカルシトニン遺伝子関連ペプチド(CGRP)と同様であり、一つのファミリーを形成しているものと考えられている。高血圧、心不全、心筋梗塞、慢性腎不全のような病態では、血中のAMが重症度に比例して高値を示し、特にエンドトキシンショックのような病態では、AMが著増することが報告されている。 AMの循環調節系における病態生理学的意義を実際に生体レベルで明らかにするためには、トランスジェニック動物における検討が有用であると考えられる。そこで本研究では、AMの循環調節系における生理学的意義を明らかにするため、AM過剰発現マウスを樹立し、正常マウスと比較したときの循環動態の変化の検討を行い、更に病態モデルとして、エンドトキシンショックに対する反応の変化を検討した。 AMのような血管作動性ペプチドを血管系に効率よく、生理的な分布に近い形で選択的に過剰発現させるためには、血管系に比較的選択的に発現し、しかも発現レベルの高い遺伝子のプロモーター領域を導入遺伝子の発現システムとして応用することが考えられる。そこで本研究では、こうした条件を満たす血管作動性物質の一つであるエンドセリン1(ET-1)に注目し、その前駆体であるPPET-1(preproendothelin-1)のプロモーター領域を遺伝子発現システムに応用した。 BALBcマウスのゲノムライブラリーよりPPET-1のプロモーター領域(9.2kb)をクローニングし、これにAM過剰発現マウス作成用の導入遺伝子として、open reading frameを含むラットAM cDNA0.7kbと、SV40由来のpoly A additional signal0.7kbを結合した計10.6kbの遺伝子コンストラクトを作成した。 導入遺伝子を培養ブタ血管内皮細胞にトランスフェクションし、ノーザンブロット解析を行うと、AMのmRNAレベルでの発現が確認され、また培養上清中のAM濃度をRIA法により測定すると、上清中のAM濃度の上昇が確認された。 この導入遺伝子をB6C3F1♀*C3H♂マウス由来の受精卵の雄性前核にマイクロインジェクション法にて導入し、トランスジェニックマウスを作成した。産まれてきた計350匹のマウスについて、尻尾から抽出したゲノムDNAのサザンブロット解析を行い、28匹に導入遺伝子のゲノムへの挿入が確認された。また元のPPET-1遺伝子と導入遺伝子のバンド濃度の比較により、導入遺伝子のコピー数は1コピーから約30コピーと推測された。 導入遺伝子の発現の確認は、RT-PCR、ノーザンブロット解析、及びRIAによるAMの定量にて行い、組織における発現パターンの確認を免疫組織染色にて行った。導入遺伝子の挿入が確認された28系列のうち1系列(AMC35)のマウスは野生型と比較して大動脈において選択的にAMの8.5倍の過剰発現が認められ、もう1系列(AMC15)は大動脈において3.2倍の過剰発現が認められた。また両方の系列とも肺、腎臓及び血漿中においても2-3倍過剰発現が認められた。 AM C末端を認識する抗ラットAM抗体を用いた免疫組織染色では、胸部大動脈切片において、血管内膜及び、中膜に強いAM発現が認められた。また腎臓では、糸球体及び輸出入動脈、肺では気管上皮に発現を認め、前に栗原らが報告したPPET-1遺伝子発現システムを用いた、レポーター遺伝子のトランスジェニックマウスでの結果と同じ発現パターンが確認された。これら2系列のマウスは、外見、行動上異常を認めず、共にヘテロ同士の交配によりホモの個体を得ることができた。 AMの慢性過剰発現下における血圧の変化を検討するため、生後8週から10週の雄のAM過剰発現マウス(Tg)及びそれと同腹の野生型マウス(W)について、ハロセン麻酔下に大腿動脈内へ観血的連続圧測定のためのカニュレーションを行った。圧測定は術後5時間以上経過してマウスが完全に覚醒した状態において、無拘束の状態にて行った。AM過剰発現マウスでは有意に平均血圧の低下(Tg:109.3+-4.7vs W:124.4+-2.7mmHg,P<0.01)が認められた。心拍数は共に738/min程度で有意差を認めなかった。また平均血圧の低下は1%ハロセン麻酔下においても認められた(Tg:79.0+-2.4vs W:86.8+-2.2mmHg,p<0.05)。 次に麻酔下にて大腿動脈、大腿静脈双方にカニュレーションを行い、圧測定と同時にNO合成阻害剤であるL-NMMAを静脈内投与したところ、血圧上昇の効果は、AM過剰発現マウスで有意に大きく認められた(Tg:21.1±3.3vs W:10.7±1.3%,p<0.01)。 AMを血管系に過剰発現させることで低血圧マウスが得られたことから、AMは慢性的な過剰発現下においても降圧ペプチドとして循環調節に関与していると考えられ、その降圧効果の一つとしてNO産生上昇を介した経路が考えられた。 次にAMの過剰発現が、エンドトキシンショックに対する生体の反応に変化をもたらすか検討するため、AM過剰発現マウス及び野生型のマウスについて、LPS(lipopolysaccharide)及びD-GalN(D-galactosamine)の併用腹腔内投与によるエンドトキシンショックモデルにおける両者の反応の違いを検討した。低容量のLPS(LPS10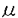 g/kg,D-GalN8mg)投与時の24時間後の生存率はAM過剰発現マウスでは92.9%、野生型では62.5%(P<0.05)、高容量のLPS(LPS100 g/kg,D-GalN8mg)投与時の24時間後の生存率はAM過剰発現マウスでは92.9%、野生型では62.5%(P<0.05)、高容量のLPS(LPS100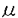 g/kg,D-GalN8mg)投与時の24時間後の生存率はAM過剰発現マウスでは78.5%、野生型では44.0%(P<0.01)とAM過剰発現マウスで有意にエンドトキシンショックにおける生存率が高いという結果が得られた。 g/kg,D-GalN8mg)投与時の24時間後の生存率はAM過剰発現マウスでは78.5%、野生型では44.0%(P<0.01)とAM過剰発現マウスで有意にエンドトキシンショックにおける生存率が高いという結果が得られた。 LPS投与後6時間後、野生型では、肝臓の腫大と黒色調の色調の変化が強く認められ、組織所見では著明な肝細胞の空胞変性、出血、顆粒球浸潤が観察された。一方、AM過剰発現マウスではこれらの変化は弱く、また組織所見では、類洞の収縮、軽度の顆粒球浸潤が認められるのみであった。こうした結果からAMの過剰発現はエンドトキシンショックに対して防御的に働いており、その原因の一つとして、このエンドトキシンショックモデルにおける肝障害を軽減させている可能性が示された。 エンドトキシンショックにおけるAMの上昇が実際に生体にとってどのような意味を持っているかは現在のところ分かっていない。AMの強力な降圧作用を考えると、エンドトキシンショックにおけるAMの上昇はショックに伴う悪性低血圧に絡む病因的なものであるとも考えられるわけであり、今回樹立したAM過剰発現マウスは元々の血圧が野生型と比較して低いのに関わらず、エンドトキシンショックに対しては抵抗性であるという点で興味深い結果が得られた。 AM過剰発現マウスがエンドトキシンショックに対して抵抗性を示す理由としては、エンドトキシンショックの際に発現が誘導されるET-1などの血管収縮物質が、肝小葉内の類洞を構成するIto cellやfat-sorting cellなど平滑筋の性質を持つ細胞の収縮をもたらし、肝臓微少循環障害を引き起こすのに拮抗し、過剰発現されたAMが血管拡張物質として、組織微少循環を維持させることに働いている可能性が考えられる。実際にこれらの細胞上にはET-1及びAM receptorが豊富に存在しており、灌流量調節に関与していることが報告されている。また血管拡張物質による組織循環の保護作用は、AMと同様強力な血管拡張因子であるNOについても報告されており、NOの産生をNO合成酵素阻害剤で抑制してしまうと、エンドトキシンショックに伴う低血圧は補正できる一方、肝障害を助長して結果的に死亡率が高くなってしまうといわれている。 もう一つの可能性としては、AM自身が抗炎症作用を持つということも考えられ、実際にAMは肺において肺胞マクロファージからの炎症性サイトカインの産生を抑制するという報告もなされている。 AMの過剰発現がエンドトキシンショックに対する抵抗性を与える機序については更なる検討が必要であるが、今回樹立した血管選択的AM過剰発現マウスは、ショックを始めとしたAMの各種の循環器疾患における意義を考える上で重要な動物モデルになることが期待される。 |