第一章 分泌を定量するために用いた第一の方法は膜容量測定である。分泌物は細胞内で合成されたのち脂質二重膜に囲まれた分泌小胞にあらかじめ貯えられる。調節的分泌においてはこれらの小胞は刺激に応じて細胞膜と融合する。その初期過程は、径8-10Åの融合細孔の形成にあると考えられ、伝達物質の場合この細孔を通る放出が重要視されている。この融合過程を開口放出と呼び、その際に起こる膜面積の増大を計測するのが膜容量測定の理念である。本法ではミリセカンド単位での定量化が可能であり、従来のインスリン分泌測定法(RIA法、溶血法)に比して格別に高い時間解像度を持つ。この高い時間分解能と定量性の両者をもって、私は開口放出機構の解折を行った。
一方、カルシウム依存性の開口放出を研究するにあたっては、分泌の誘発方法も重要である。生理的な脱分極刺激を与えた場合には、種々の代謝反応のもとにカルシウム動態が時間的・空間的に複雑に変化するために、開口放出の時間経過はその測定不能のカルシウム濃度変化に依存する。したがって、カルシウム結合から開口放出にいたる過程を直接的に検討する事は困難であった。この困難を克服するためにケイジドカルシウム試薬を利用した。これはカルシウムキレート剤を化学的に修飾したものであり、特徴として紫外線を照射するとキレート力が1ミリ秒以内に失活する。したがって、ケイジドカルシウム試薬を適宜カルシウムと混ぜ合わせて、あらかじめ細胞内に投与したのち任意の時間に紫外線を照射すると、時間的空間的に一様なカルシウムの濃度上昇を細胞に与える事が可能となる。実際の濃度上昇は低親和性カルシウム指示薬BTCを二波長励起してその蛍光比より求めた。
8週齢以上のマウスより膵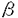 細胞を単離培養して、ホールセルクランプを行った。前述のケイジドカルシウム試薬と紫外線照射を併用して細胞に
細胞を単離培養して、ホールセルクランプを行った。前述のケイジドカルシウム試薬と紫外線照射を併用して細胞に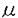 M以上のカルシウムジャンプを与えると、膜容量は三相性に増加した。もっとも速い増加成分が膜コンダクタンスのあらゆる変化に先行している点、および遅い成分もコンダクタンスの変化とは時間的経過を異にした点から、これらは膜容量の増大を真に反映しているものと考えられた。増加相は、100ms以内に出現する速い成分(fast)とそれに続く遅い成分(slow)に分けられる。さらにこの遅い成分は、時定数が1秒前後の比較的速い成分(slow-1)と10秒以上に亘って持続するより緩徐な成分(slow-2)に区分可能である。また、各増加相には場合によってそれぞれに特有な時間経過を持つ膜容量の減少、すなわちエンドサイトーシスが後続してみられた。
M以上のカルシウムジャンプを与えると、膜容量は三相性に増加した。もっとも速い増加成分が膜コンダクタンスのあらゆる変化に先行している点、および遅い成分もコンダクタンスの変化とは時間的経過を異にした点から、これらは膜容量の増大を真に反映しているものと考えられた。増加相は、100ms以内に出現する速い成分(fast)とそれに続く遅い成分(slow)に分けられる。さらにこの遅い成分は、時定数が1秒前後の比較的速い成分(slow-1)と10秒以上に亘って持続するより緩徐な成分(slow-2)に区分可能である。また、各増加相には場合によってそれぞれに特有な時間経過を持つ膜容量の減少、すなわちエンドサイトーシスが後続してみられた。
従来、副腎髄質細胞を用いた研究ではこのような多相性の膜容量増加は、一つの開口放出路における多段階の膜融合準備過程を反映するものと考えられてきた。すなわち、膜融合の準備の完了したものが速く放出され、整っていないものが遅く放出されるという考え方である。しかし、膵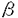 細胞にはインスリンやアミリンを含む大型有芯小胞(large dense-core vesicles,LVs)のほか、GABAを含むシナブス小胞様小胞(small clear microvesicles,SVs)の存在する事が電子顕微鏡を用いて観察されている。そこで、複数の膜容量増加成分が異なる小胞からの分泌を反映しうるという仮説を検討するために、アンペロメトリーを併用したさらなる解析を試みた。
細胞にはインスリンやアミリンを含む大型有芯小胞(large dense-core vesicles,LVs)のほか、GABAを含むシナブス小胞様小胞(small clear microvesicles,SVs)の存在する事が電子顕微鏡を用いて観察されている。そこで、複数の膜容量増加成分が異なる小胞からの分泌を反映しうるという仮説を検討するために、アンペロメトリーを併用したさらなる解析を試みた。
アンペロメトリーとは分泌された物質の酸化還元反応を利用して、分泌物を直接経時的に定量化する方法である。具体的には、分沁物の酸化電位に保持した微小電極を細胞の近傍において、放出反応を測定する。本法もミリセカンドの時間解像度を有する上に、単一小胞の膜融合に対応する量子的な分泌の検出を可能とし、開口放出のもっとも絶対的な測定方法と考えられる。そこでLVに選択的に取り込まれるセロトニンを数時間培養液内で細胞にロードした後、炭素繊維電極を用いてその分泌反応を検出した。過去の多くの研究より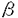 細胞におけるセロトニンの取り込みは、分泌小胞のなかではLVに選択的であると考えられている。
細胞におけるセロトニンの取り込みは、分泌小胞のなかではLVに選択的であると考えられている。
膵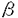 細胞に膜容量測定とアンペロメトリーを同時に併用して検討したところ、驚くべきことにインスリン顆粒の分泌は遅い膜容量増加相のみに一致することが判明した。また、膜容量を時間微分して求めた単位時間あたりの分泌量と、酸化電流との比較から、遅い膜容量増加相はインスリン顆粒の開口放出を反映することが示された。一方、速い膜容量増加相はインスリン顆粒以外の分泌小胞、すなわちSVの分泌に対応する可能性が示された。類推題材としてPC12細胞の実験がある。当細胞にカルシウムジャンプを与えると二相性の膜容量増加が生じるが、その遅い増加相に一致しては、LVに含まれるカテコラミンがアンペロメトリーで検出されるのに対し、速い増加相では、SVに含まれるアセチルコリンがバイオセンサーで検出されることが示された。
細胞に膜容量測定とアンペロメトリーを同時に併用して検討したところ、驚くべきことにインスリン顆粒の分泌は遅い膜容量増加相のみに一致することが判明した。また、膜容量を時間微分して求めた単位時間あたりの分泌量と、酸化電流との比較から、遅い膜容量増加相はインスリン顆粒の開口放出を反映することが示された。一方、速い膜容量増加相はインスリン顆粒以外の分泌小胞、すなわちSVの分泌に対応する可能性が示された。類推題材としてPC12細胞の実験がある。当細胞にカルシウムジャンプを与えると二相性の膜容量増加が生じるが、その遅い増加相に一致しては、LVに含まれるカテコラミンがアンペロメトリーで検出されるのに対し、速い増加相では、SVに含まれるアセチルコリンがバイオセンサーで検出されることが示された。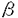 細胞の速い膜容量増加相の生物物理学的性質が、PC12のそれに類似する事実を併せ考え、
細胞の速い膜容量増加相の生物物理学的性質が、PC12のそれに類似する事実を併せ考え、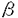 細胞の速い相ではGABAが分泌されている可能性が強いと推察している。
細胞の速い相ではGABAが分泌されている可能性が強いと推察している。
また、詳細に検討したところ三つの開口放出路が類似したカルシウム依存性(Km:18-26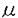 M)を示す事実をも見出した。それは、三つの分泌経路全てが生理的な状況で
M)を示す事実をも見出した。それは、三つの分泌経路全てが生理的な状況で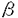 細胞の機能発現に関与している構造を示唆している。従来の膜容量計測を用いた内分泌細胞の研究では、膜容量増加分はすべてLVの放出反応に由来すると解釈されてきた。
細胞の機能発現に関与している構造を示唆している。従来の膜容量計測を用いた内分泌細胞の研究では、膜容量増加分はすべてLVの放出反応に由来すると解釈されてきた。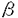 細胞におけるGABA分泌の実態や、その機能的意義には不明な点が多いが、今後はSVの関与も考慮しつつ結果を再検討する必要がある。
細胞におけるGABA分泌の実態や、その機能的意義には不明な点が多いが、今後はSVの関与も考慮しつつ結果を再検討する必要がある。
さらにアンペロメトリーによる検討を進めたところ、LVの融合反応には細胞によって2種類あることが明らかになったつは、膜容量増加のslow-1相とslow-2相の双方に対応してLVの融合が検出される群(タイプ1)、もう一つはslow-2相のみに一致して融合が検出される群(タイプ2)である。両者の分泌の時間経過は統計学的に有意に異なり、インスリン顆粒には開口放出路が二種類存在することが示唆された。すなわち、細胞内カルシウム濃度が上昇した後、比較的早期に速い時間経過で放比される分泌モードと、遅い時期に緩徐な時間経過で放出される分泌モードの存在が判明した。
第二章 次に、第一章で明らかにされたインスリン顆粒の二つの分泌モードが、代謝状態によって調節されている可能性を検討した。以前は細胞内液にATPを含めず細胞外液にフォルスコリンを加えた状態で実験を行っていたが、実験を重ねるにつれ細胞内ATP濃度が分泌の速さに関与している傾向があるのに気がついた。そこで、第二章では細胞内ATP濃度をコントロールした上で、言及のないかぎり細胞外にフォルスコリンは添加せず、エンドサイトーシスの影響を受けないアンペロメトリーの結果を主とした解析を進めた。
細胞内ATP濃度を0-5mMに調節してからカルシウムジャンプを与えたところ速い分泌経路(モード1)が選択的に増加し、遅い分泌経路(モード2)は濃度に依存せず一定量を示した。ATPのこの作用が加水分解反応を介しているかを検討するために、非水解型アナログであるATP-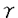 -Sで置換したところ、モード1はコントロールの20倍に増加した。一方、非水解型アナログのAMP-PNPは前者とは異なりリン酸化反応の基質を提供しないが、これで置換するとモード1は激減した。以上よりATPの作用は水解反応ではなくカイネースの作用を持って具現化されていると考えられた。さらに、アデニレートサイクレースの賦活剤であるフォルスコリンの細胞外投与やcAMPの細胞内注入により分泌が速くなり、A-キナーゼの阻害剤であるRp-cAMPの投与にて遅くなることから、ATPのモード調節作用はアデニレートサイクレースとそれに続くAキナーゼの活性化を介していることが明らかになった。また、その作用点はATP-
-Sで置換したところ、モード1はコントロールの20倍に増加した。一方、非水解型アナログのAMP-PNPは前者とは異なりリン酸化反応の基質を提供しないが、これで置換するとモード1は激減した。以上よりATPの作用は水解反応ではなくカイネースの作用を持って具現化されていると考えられた。さらに、アデニレートサイクレースの賦活剤であるフォルスコリンの細胞外投与やcAMPの細胞内注入により分泌が速くなり、A-キナーゼの阻害剤であるRp-cAMPの投与にて遅くなることから、ATPのモード調節作用はアデニレートサイクレースとそれに続くAキナーゼの活性化を介していることが明らかになった。また、その作用点はATP-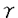 -Sによって阻害されない事から、モーター蛋白やプライミングなどATP水解を要する膜融合の準備過程が完了した小胞に対して、A-キナーゼが最終的なスイッチとしてはたらくことが判明した。また、各モードの時定数を一定に保ったまま、モード1の分泌量を選択的に増やすことが明らかになった。
-Sによって阻害されない事から、モーター蛋白やプライミングなどATP水解を要する膜融合の準備過程が完了した小胞に対して、A-キナーゼが最終的なスイッチとしてはたらくことが判明した。また、各モードの時定数を一定に保ったまま、モード1の分泌量を選択的に増やすことが明らかになった。
すなわちインスリン分泌の約9割を占める速いモードは、(1)ATP加水分解を終えた後、Aキナーゼによるリン酸化を受けて初めてCa感受性を持つこと、(2)そのリン酸化は細胞内ATP濃度に強く依存し、最終ATPセンサーを構成することを明らかにした。この最終ATPセンサーにはアデニレートサイクレースもが含まれており、cAMPの濃度を変えるすべての調節因子がATP感受性を変える事により、インスリン分泌の最終段階の9割を直接制御している事が明らかになった。これは生理的な脱分極を誘導するK-ATPチャネルと対等な重要性を持つものと考えられた。細胞内のエネルギー代謝が膜の電気的性質のみならず開口放出の最終過程を直接調節しうる点、膵 細胞は特異な存在である可能性が示された。これらの知見は、今後Aキナーゼの基質となる膜融合関連蛋白の同定を含めて、開口放出機構の解明に糸口を与えると同時に、インスリン初期分沁の減少を主徴とする糖尿病の冶療と成因究明に向けて、新たな理論的基礎を提供する。
細胞は特異な存在である可能性が示された。これらの知見は、今後Aキナーゼの基質となる膜融合関連蛋白の同定を含めて、開口放出機構の解明に糸口を与えると同時に、インスリン初期分沁の減少を主徴とする糖尿病の冶療と成因究明に向けて、新たな理論的基礎を提供する。