T細胞は、T細胞抗原受容体(TCR)によって外来抗原を認識し、抗原侵入から排除に至る一連の免疫反応の中心的役割を果たしている。TCR/CD3複合体からの刺激は、受容体と会合するチロシンキナーゼとその下流の一連のシグナル伝達経路を介して最終的に核内に伝達され、T細胞分化・増殖そしてサイトカインなどの免疫応答遺伝子の転写活性化を引き起こすことが知られている。そして近年、このTCR刺激のシグナル伝達経路において、多くのチロシンキナーゼの関与が報告されている。 そこで私は、T細胞におけるTCR刺激によるシグナル伝達に関与する分子を解析するために、ヒトTリンパ球性白血病細胞株(H9細胞)を用いて、抗CD3抗体で刺激を行い、リン酸化される蛋白について検討した。その結果、140kDa,120kDa,105-110kDa,70kDa,55-60kDaのチロシンリン酸化される蛋白を認め、140kDaはPLC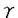 ,120kDaはCbl,70kDaはZAP-70,55-60kDaはFyn/Lckと推定されたが、105-110kDaの蛋白質は不明であった。その蛋白質は、抗Cas抗体で免疫沈降されることから、p130Cas(Cas)のalternating splicing form、Casに会合する蛋白、あるいはCasと相同性が高く抗Cas抗体にcross reactする蛋白である可能性が考えられた。 ,120kDaはCbl,70kDaはZAP-70,55-60kDaはFyn/Lckと推定されたが、105-110kDaの蛋白質は不明であった。その蛋白質は、抗Cas抗体で免疫沈降されることから、p130Cas(Cas)のalternating splicing form、Casに会合する蛋白、あるいはCasと相同性が高く抗Cas抗体にcross reactする蛋白である可能性が考えられた。 ところでCasとは、1994年にSakaiらが、p60v-Srcおよびp47V-Crkにてトランスフォームした線維芽細胞内で著明にチロシンリン酸化される蛋白としてクローニングした、docking proteinである。構造はN末端に1つのSH3ドメインと、それに続いて15個のSH2結合モチーフを持つsubstrate domain(SD domain)、そしてC末端のN末端寄りにSrc-SH3binding motifであるproline-rich region、そしてSrc-SH2binding motifと続き、分子量は130kDaである。リン酸化されたCasは、Crk-SH2ドメインと結合することから、Crk-associated substrate,Casと名付けられた。そしてCasは、線維芽細胞において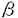 1インテグリン刺激によりチロシンリン酸化を受けること、そしてCas-SH3ドメインとp125Fak(FAK)のproline rich regionが恒常的に結合していることも報告されている。 1インテグリン刺激によりチロシンリン酸化を受けること、そしてCas-SH3ドメインとp125Fak(FAK)のproline rich regionが恒常的に結合していることも報告されている。 一方、1996年にMinegishiらは、H9細胞において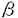 1インテグリン刺激によりチロシンリン酸化を受ける105kDaと125kDaの蛋白質について、125kDaの蛋白質はFAKであることを説明し、105kDaの蛋白質をクローニングし、新規情報伝達分子Lymphocyte-Cas,p105CasL(CasL)と名付けた。この105kDaの蛋白質は同時に、LawらからHEF1(Human Enhancer of Filamentaion1)という名でも報告された。CasLは、CCasとアミノ酸配列にて64%の相同性を持ち、構造はN末端に1つのSH3domain、それに続いて13個のSH2結合モチーフからなるSDdomain、C末端にはSrc-SH2binding motifを持つが、Casとは異なりproline rich regionは持たないp130Cas-related docking proteinである。CasLは、v-crkやv-srcをトランスフォームした細胞内でも、インテグリン経由の刺激で著明にチロシンリン酸化され、リン酸化されたCasLは、Crk-SH2ドメインと会合する。そしてCas同様CasL-SH3ドメインが、FAKのproline rich regionと会合することも知られている。両者はこのように構造や機能が似ているが、発現が異なり、CasLは血球細胞にしか発現していないことが判明している。 1インテグリン刺激によりチロシンリン酸化を受ける105kDaと125kDaの蛋白質について、125kDaの蛋白質はFAKであることを説明し、105kDaの蛋白質をクローニングし、新規情報伝達分子Lymphocyte-Cas,p105CasL(CasL)と名付けた。この105kDaの蛋白質は同時に、LawらからHEF1(Human Enhancer of Filamentaion1)という名でも報告された。CasLは、CCasとアミノ酸配列にて64%の相同性を持ち、構造はN末端に1つのSH3domain、それに続いて13個のSH2結合モチーフからなるSDdomain、C末端にはSrc-SH2binding motifを持つが、Casとは異なりproline rich regionは持たないp130Cas-related docking proteinである。CasLは、v-crkやv-srcをトランスフォームした細胞内でも、インテグリン経由の刺激で著明にチロシンリン酸化され、リン酸化されたCasLは、Crk-SH2ドメインと会合する。そしてCas同様CasL-SH3ドメインが、FAKのproline rich regionと会合することも知られている。両者はこのように構造や機能が似ているが、発現が異なり、CasLは血球細胞にしか発現していないことが判明している。 私は、Minegishiらの報告をうけ、105kDaの蛋白質は、CasLではないかと考えた。そしてCasLの抗体を作成し、TCR刺激を与えたH9細胞を、抗CasL抗体で免疫沈降し、抗Cas抗体でウエスタンブロットした結果、この蛋白質はCasLであることが判明した。そこで、in vivoでTCR刺激におけるCasLとCrkの会合を検討した結果、CasLとCrkの会合が認められた。また、接着刺激におけるCasLとCrkの会合を検討した結果、TCR刺激同様、CasLとCrkの会合が認められた。次にCrkのGST-fusion proteinを作成し、in vitroでCasLとCrk会合部位について検索したことろ、TCR刺激により、チロシンリン酸化依存性にCasLとCrk-SH2ドメインが結合することが明らかになった。そしてコントロールとしてAsh/Grb2のGST-fusion proteinを用いた検討より、Ash/Grb2-SH3ドメインとp120Cbl(Cbl)が恒常的に結合していることも明らかになった。また末梢血T細胞においても同様の解析を行ったところ、TCR刺激によりCasLおよびCrkのチロシンリン酸化の亢進を認め、CasLとCrkの会合が誘導されることが明らかになった。 TCR刺激によるシグナル伝達経路は、インテグリンによる刺激伝達経路と互いに協調しあうと報告されている。私がここで示したCasLもまた両方に携わるシグナル伝達分子の1つであることが明らかになった。そこでTCR刺激と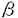 1インテグリン刺激で時間経過によるCasLのリン酸化の程度を相対的に数値化して比較検討した結果、TCR刺激の方が 1インテグリン刺激で時間経過によるCasLのリン酸化の程度を相対的に数値化して比較検討した結果、TCR刺激の方が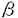 1インテグリン刺激より早期にCasLをリン酸化させること、 1インテグリン刺激より早期にCasLをリン酸化させること、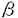 1インテグリン刺激によりCasLは長期にリン酸化状態が持続することが明らかになった。このことからTCR刺激によるCasLのチロシンリン酸化に関与するシグナル伝達経路とインテグリン刺激によるシグナル伝達経路は異なる可能性が考えられた。 1インテグリン刺激によりCasLは長期にリン酸化状態が持続することが明らかになった。このことからTCR刺激によるCasLのチロシンリン酸化に関与するシグナル伝達経路とインテグリン刺激によるシグナル伝達経路は異なる可能性が考えられた。 CasLは前述したように、構造上SH3ドメインを持つことおよびSH2結合モチーフを持つことから、他のチロシンキナーゼとの会合が予想された。そこでH9細胞においてTCR刺激によりCasLと会合するチロシンキナーゼを検討したところ、56-59kDaの蛋白質が共沈した。この蛋白質を分子量からFynあるいはLckと推定し、解析した。 Fynは、CD3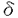 鎖のITAMと結合している最初のチロシンキナーゼとして見い出された、分子量59kDaの蛋白であり、T細胞においてはTCRと直接会合する唯一のSrc family kinaseである。 鎖のITAMと結合している最初のチロシンキナーゼとして見い出された、分子量59kDaの蛋白であり、T細胞においてはTCRと直接会合する唯一のSrc family kinaseである。 Lckは、主にCD4,CD8のco-recepterと複合体を作っているチロシンキナーゼとして同定された、分子量56kDaの蛋白である。 H9細胞におけるTCR刺激によりFynおよびLckのチロシンリン酸化を検討したところ、両者ともリン酸化の亢進がみられた。次に抗Fyn抗体、抗Lck抗体で免疫沈降し、抗Cas抗体でウエスタンプロットしたところ、TCR刺激によりFynとCasL、LckとCasLの会合が誘導されることが明らかになった。さらにin vitroで、会合部位を検討した結果、CasLとFyn-SH2の会合、およびCasとFyn-SH3の恒常的結合が認められた。 次に全身性エリテマトーデス(SLE)のモデルマウスとして知られており、かつその異常なCD4-/CD8-のT細胞においてFynの恒常的なチロシンリン酸化の亢進がみられるMRL/Mp-lpr/lpr(lpr)マウスのT細胞を用い、FynとCasLおよびLckとCasLの会合について検討した。lprマウスのT細胞において、Cas-L,Fyn,Lckそれぞれの発現の増加と恒常的なFynとCasLおよびLckとCasLとの会合が明らかになった。 以上より、CasLはT細胞においてインテグリンおよびTCR刺激の両方に携わるシグナル分子の一つであることが明らかになった。CasLの下流の経路としては、インテグリン刺激同様、チロシンリン酸化依存性にCasLはCrkと結合することから、TCR刺激において誘導されるCasLのチロシンリン酸化が、adaptor proteinのCrkとの結合を惹起し、CrkはGrb2,SOSまたはC3Gとの複合体を形成しながら、Rasの活性化およびMEK,ERKの活性化を経て、T細胞の増殖に関わっていく可能性が考えられた。T細胞においては、TCR剌激によりCD3直下のFynとLCKがCasLに関与する可能性が高いこと、B細胞のBCR刺激では、BCRに結合するLynとCasLが結合するという報告があることから、CasLは、T細胞およびB細胞レセプター経由のシグナル伝達系において同様の役割を演じている可能性が高いと考えられた。今後、TCR刺激伝達系におけるCasLの責任kinaseの検討とともに他のチロシンキナーゼとの関わりを明らかにし、TCR刺激によるシグナル伝達経路の解明に役立てたいと考えている。 |