インスリンは細胞膜表面の受容体に結合後そのチロシンキナーゼを活性化し、phosphatidylinositol3-kinase(PI3-kinase)やmitogen-activated protein kinase(MAP kinase)等の種々の酵素を活性化して、最終的に細胞内への糖の取り込みや蛋白合成、細胞増殖といった生物学的作用を発揮する。分子量170kDaのinsulin receptor substrate(IRS)-1はインスリン刺激後最も顕著にチロシンリン酸化を受ける細胞内基質であり、そのチロシンリン酸化部位を介して種々のシグナル分子と結合し、下流にシグナルを伝えるのに大きな役割を果たしていることが種々の培養細胞の系で報告されてきた。IRS-1の生体内での役割を明らかにするために作製されたIRS-1欠損マウスでは、成長障害とインスリンの血糖降下作用に対する感受性の低下を認めたが、その程度は予想よりもはるかに軽かった。IRS-1欠損マウスではインスリン刺激後野生型ではあまり認められない分子量180kDaのIRS-2のチロシンリン酸化を著明に認め、このことがIRS-1欠損に対する代償メカニズムの少なくとも一部であると考えられた。 本研究の前半部分ではこのIRS-1欠損マウスと野生型マウスにおいて、インスリンの生理的標的器官である肝臓と骨格筋における種々のインスリン作用を比較検討し、IRS-1とIRS-2の役割を明らかにすることを試みた。IRS-1欠損マウスの骨格筋ではインスリン刺激によるPI3-kinaseの活性化や細胞内への糖の取り込み、70kDa S6kinaseやMAP kinaseの活性化、mRNAの翻訳や蛋白合成が野生型マウスと比較して有意に低下していた。それに対して肝臓ではインスリン刺激によるPI3-kinaseやMAP kinaseの活性化のごときインスリン作用においては、IRS-1欠損マウスと野生型マウスとの間で有意な差は認められなかった。IRS-1欠損マウスの骨格筋と肝臓におけるインスリンに対する反応性の違いの原因を明らかにするため、インスリン刺激によるIRS-1とIRS-2のチロシンリン酸化量を比較検討したところ、肝臓ではIRS-1欠損マウスにおけるIRS-2のチロシンリン酸化は野生型におけるIRS-1のチロシンリン酸化とほぼ同程度認められたのに対して、骨格筋では20-30%と著明に低下していた。 以上より以下のことが示唆された。 1)IRS-1はインスリン受容体チロシンキナーゼによって最も顕著にチロシンリン酸化を受ける基質であり、骨格筋及び肝臓においてインスリンの重要な生物学的作用である細胞内への糖の取り込みを含んだ糖代謝や蛋白合成において中心的な役割を果たしている。 2)IRS-1欠損マウスにおけるインスリンに対する感受性の低下は骨格筋が原因であり、一般的なヒト糖尿病の場合と同じであったので、IRS-1欠損マウスは今後研究を進めていくうえでよきモデル動物となりうる。 3)IRS-1欠損に対する代償の程度はIRS-2のチロシンリン酸化の程度と相関したことより、IRS-2もまた糖代謝や蛋白合成において重要な働きをしている。 成長ホルモン受容体(growth hormone receptor;GHR)はサイトカイン受容体スーパーファミリーに属し、GHの結合により細胞内でJAK2(Janus kinase)を活性化し、STAT(signal transducers and activators of transcription)やMAP kinaseといったシグナル分子を活性化し、最終的に特異的な遺伝子の発現等の生物学的作用を発揮する。個体の成長を促進する以外に糖輸送等のインスリン様の代謝作用を有するGHが、培養細胞の系でIRS-1をチロシンリン酸化することが報告されたので、本研究後半部分ではGH刺激によりその標的器官である肝臓においてMAP kinaseやPI3-kinaseが活性化されるに至る情報伝達経路の解明を試みた。 マウス肝臓でGH依存性にJAK2、GHR,STAT5の他、分子量180kDaのチロシンリン酸化蛋白を認めたが、特異抗体及びIRS-1欠損マウスを用いた解析により、この180kDaのチロシンリン酸化蛋白は大部分epidermal growth factor receptor(EGFR)であることが示唆された。EGFRはマウス肝臓にて、時間及びGH濃度依存性にチロシンリン酸化され、Grb2(growth factor receptor bound protein 2)と結合し、同時にMAP kinaseを活性化した。このEGFRのGH依存性のチロシンリン酸化のメカニズム及びGHの細胞内情報伝達における役割を明らかにするため、内因性にはEGFRを発現しないCHO-GHR細胞に種々のEGFR変異体を発現させ、比較検討した。その結果GH依存性に最大にMAP kinaseが活性化されc-fosが発現誘導されるためには、EGFRの内在性のチロシンキナーゼは必要ないがチロシンリン酸化サイトが必要であることが示唆された。さらにEGFで刺激された時と同様に、EGFRの1068番目のチロシンが、GHで刺激された場合の主なチロシンリン酸化サイトかつGrb2結合サイトであることが示唆された。次にGH依存性にEGFRをチロシンリン酸化するチロシンキナーゼを同定するため、JAK2の優性抑制型変異体及びJAK2欠損細胞を用いて解析を行ったところ、JAK2依存性であることが示唆された。さらにJAK2がGH依存性にEGFRを直接チロシンリン酸化するのかどうかを明らかにするため、免疫沈降及びin vitroでのkinase assayを行ったところ、GH依存性にEGFRとGHR/JAK2 complexとの親和性が高まり、JAK2がGH依存性にEGFRを直接チロシンリン酸化しうることが示唆された。 一方培養細胞の系で報告されたIRS-1/IRS-2のチロシンリン酸化は、特異抗体を用いた検討によりマウス肝臓でもGH依存性に認められた。その程度はインスリン刺激によるIRS-1/IRS-2のチロシンリン酸化やGH刺激によるEGFRのチロシンリン酸化と比較してはるかに少なかった。しかしながらマウス肝臓で認められるGH依存性のPI3-kinase結合チロシンリン酸化蛋白は、野生型マウスではIRS-1であり、IRS-1欠損マウスではIRS-2であった。これらは、インスリンと比較するとはるかに少ないもののマウス肝臓で実際に認められるGH依存性のPI3-kinase活性化の主な情報伝達経路となっていることが示唆された。 以上本研究後半部分より以下のことが示唆された。 1)GH刺激により活性化されたJAK2によって、EGFRはその内在するチロシンキナーゼとは独立にチロシンリン酸化され、docking proteinとしてGrb2の結合部位を供給し、MAP kinase活性化やc-fosの発現などの生物学的作用を伝達している。これはサイトカイン受容体スーパーファミリーと増殖因子受容体情報伝達経路の新規のクロストークであると考えられた。 2)マウス肝臓でGH依存性にIRS-1/IRS-2のチロシンリン酸化を認めたが、その程度はインスリン刺激によるIRS-1/IRS-2のチロシンリン酸化や、GH刺激によるEGFRのチロシンリン酸化と比較してはるかに少なかった。 結語 ホルモンや増殖因子は細胞表面にあるそれぞれ固有の受容体に結合しその生物学的作用を発揮するが、それらの作用は多様性と重複性を持つことが次第に明らかとなってきた。例えばGHは主にはIGF-Iの転写促進を介して個体の成長を促していくという特異的な作用の他、IGF-Iの受容体の極めて少ない肝臓でEGFと同様にDNAの合成を促進したり、細胞内への糖の取り込みやグリコーゲン合成、脂肪分解抑制といったインスリン様の代謝作用を有したりすることが報告されている。受容体から生物学的作用発揮までを結ぶGHの細胞内情報伝達経路に関しては、JAK2を活性化してSTATをチロシンリン酸化し活性化するといったサイトカイン受容体スーパーファミリーでよく知られた情報伝達経路に加えて、本研究によりJAK2がEGFRをチロシンリン酸化してMAP kinaseを活性化する経路と、JAK2がIRS-1/IRS-2をチロシンリン酸化してPI3-kinaseを活性化する経路が、生理的標的器官である肝臓において機能していることが明らかとなった。JAK/STATの経路に関しては遺伝子ノックアウトの手法により、STAT5bがGHによる雄の二次性徴の発現に必須であることが報告されている。またEGFRのノックアウトマウスでは、IGF-I非依存性に成長していくと考えられている肝臓や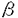 細胞の成長が障害されている。これらは、GHによるEGFRのチロシンリン酸化がMAP kinaseの活性化に重要な役割を果たしていることを示唆した本研究の結果とよく合致する。現在GHによるインスリン様の代謝作用発揮におけるIRSファミリーの役割をさらに明らかにするため、IRSファミリーノックアウトマウスの解析を続けている。このように、ホルモンや増殖因子の重複した作用に関しては、共通のシグナル分子のチロシンリン酸化にてうまく説明可能である。 細胞の成長が障害されている。これらは、GHによるEGFRのチロシンリン酸化がMAP kinaseの活性化に重要な役割を果たしていることを示唆した本研究の結果とよく合致する。現在GHによるインスリン様の代謝作用発揮におけるIRSファミリーの役割をさらに明らかにするため、IRSファミリーノックアウトマウスの解析を続けている。このように、ホルモンや増殖因子の重複した作用に関しては、共通のシグナル分子のチロシンリン酸化にてうまく説明可能である。 その一方でホルモンや増殖因子はそれぞれ固有の特異的な作用を有している。それらはリガンド特異的な分子を含めた、利用するシグナル分子の組み合わせとそれぞれの強弱によって決まるのではないかと推測されている。例えば代謝作用の強いインスリンはMAP kinaseよりもPI3-kinaseを、細胞増殖作用の強いGHはPI3-kinaseよりもMAP kinaseをよく活性化する。今後STAT5b,EGFR,IRSファミリーのそれぞれのノックアウトマウスを掛け合わせて解析することにより、IGF-Iの転写促進を含めたGHによる種々の増殖、分化促進作用発揮におけるそれぞれの情報伝達経路の相対的な寄与を明らかにすることが出来るとともに、さらにこれらの経路とは独立した重要な未知の情報伝達経路を新しく見出せる可能性があると考えられた。 |